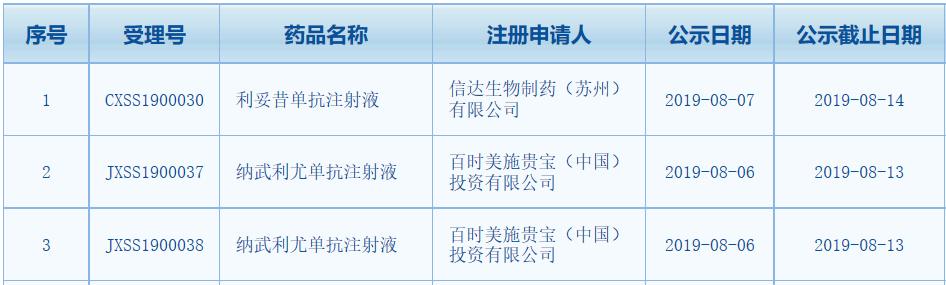
1.兩款抗體藥物上市申請(qǐng)擬納入優(yōu)先審評(píng)中國(guó)國(guó)家藥監(jiān)局(NMPA)藥品審評(píng)中心最新公告����,2款抗體藥物的上市申請(qǐng)擬納入優(yōu)先審評(píng)。分別是信達(dá)生物的利妥昔單抗注射液和百時(shí)美施貴寶的納武利尤單抗注射液����。
▲截圖來(lái)源:中國(guó)國(guó)家藥監(jiān)局(NMPA)藥品審評(píng)中心官網(wǎng)
利妥昔單抗是一種單克隆抗體,可與B淋巴細(xì)胞表面的CD20抗原結(jié)合���,介導(dǎo)補(bǔ)體依賴性細(xì)胞毒作用(CDC)和抗體依賴性細(xì)胞介導(dǎo)的細(xì)胞毒作用(ADCC)���,介導(dǎo)體內(nèi)正常及惡性B細(xì)胞溶解,從而實(shí)現(xiàn)抗腫瘤治療效果���。今年6月���。信達(dá)生物與禮來(lái)制藥共同宣布,雙方共同開(kāi)發(fā)的利妥昔單抗注射液生物類似藥(IBI301)的新藥上市申請(qǐng)已經(jīng)獲得NMPA受理���,適應(yīng)癥為非霍奇金淋巴瘤(NHL)���。此次該藥上市申請(qǐng)����,擬按優(yōu)先審評(píng)范圍(一)7款重大專項(xiàng)納入優(yōu)先審評(píng)程序����,預(yù)計(jì)申報(bào)適應(yīng)癥為NHL。若獲批上市���,該藥將成為繼復(fù)宏漢霖的漢利康之后����,第二款中國(guó)產(chǎn)利妥昔單抗生物類似藥���。
納武利尤單抗是由百時(shí)美施貴寶開(kāi)發(fā)的PD-1抗體新藥。2018年6月���,NMPA正式批準(zhǔn)納武利尤單抗用于部分非小細(xì)胞肺癌(NSCLC)成人患者���。該藥由此成為中國(guó)批準(zhǔn)注冊(cè)的首個(gè)以PD-1為靶點(diǎn)的單抗藥物����,非小細(xì)胞肺癌也是目前為止Opdivo在中國(guó)獲批的唯一一個(gè)適應(yīng)癥����。在藥物臨床試驗(yàn)登記與信息公示平臺(tái)上,該藥登記了超過(guò)20項(xiàng)臨床試驗(yàn)����,適應(yīng)癥包括胃癌、食管癌����、胃食管交界處癌、胸膜間皮瘤等���。
2.歌禮原研全口服丙肝治愈方案臨床研究入選美肝會(huì)TOP10%摘要及壁報(bào)演講

8月7日����,歌禮宣布其開(kāi)發(fā)的全口服丙肝治愈方案2/3期臨床研究摘要已通過(guò)第70屆美國(guó)肝病研究學(xué)會(huì)(AASLD)年會(huì)組委會(huì)的評(píng)定���,入選TOP10%摘要和壁報(bào)演講���。該項(xiàng)研究為大型多中心隨機(jī)雙盲安慰劑對(duì)照2/3期試驗(yàn)���,由中國(guó)大陸42家中心共同參與,共納入424例非肝硬化的GT1 HCV感染初治成人患者����。研究證實(shí):應(yīng)用拉維達(dá)韋聯(lián)合利托那韋強(qiáng)化的達(dá)諾瑞韋和利巴韋林治療12周后,治愈率(SVR12)高達(dá)99%���,且療效不受基線NS5A耐藥相關(guān)替換影響����,同時(shí)具有良好的耐受性����。拉維達(dá)韋是歌禮開(kāi)發(fā)的針對(duì)NS5A靶點(diǎn)的新一代泛基因型直接抗丙肝病毒藥物,與2018年6月初獲批上市的歌禮首個(gè)抗丙肝1類創(chuàng)新藥戈諾衛(wèi)聯(lián)合使用����,組成中國(guó)首個(gè)原研12周DAA全口服丙肝治愈方案(RDV/DNV治療方案)。
3.信達(dá)生物信迪利單抗聯(lián)合IBI305臨床研究招募一線晚期肝癌患者

8月7日���,信達(dá)生物宣布,其正在開(kāi)展信迪利單抗聯(lián)合IBI305對(duì)比索拉非尼用于晚期肝細(xì)胞癌一線治療有效性和安全性的隨機(jī)���、開(kāi)放���、多中心研究���,已得到中國(guó)國(guó)家藥監(jiān)局(NMPA)藥物臨床試驗(yàn)批件,計(jì)劃全國(guó)招募566名未接受過(guò)針對(duì)晚期肝細(xì)胞癌的全身系統(tǒng)性抗腫瘤治療的受試者����。信迪利單抗(研發(fā)代號(hào):IBI308)是重組全人源抗PD-1單克隆抗體(已上市,商品名:達(dá)伯舒)����;IBI305是重組抗血管內(nèi)皮生長(zhǎng)因子(VEGF)人源化單克隆抗體注射液(已申請(qǐng)上市)。





