今日����,專注于研發(fā)罕見病靶向治療的Eiger BioPharmaceuticals公司宣布���,該公司開發(fā)的聚乙二醇化干擾素λ(pegylated interferon-lambda,下稱Lambda)獲得FDA授予的突破性療法認(rèn)定����,治療丁肝病毒(HDV)感染。
丁型肝炎是由HDV感染造成的���,被認(rèn)為是人類病毒性肝炎中最嚴(yán)重的類型之一���。HDV感染只會(huì)在乙肝病毒(HBV)感染患者中發(fā)生。丁型肝炎與乙肝相比���,導(dǎo)致更嚴(yán)重的肝病����,與加速肝臟纖維化����,肝癌和肝功能衰竭相關(guān)。在全世界范圍內(nèi)���,丁型肝炎可能影響1500萬(wàn)至2000萬(wàn)的人群����,在各地的流行程度各不相同����。據(jù)統(tǒng)計(jì),大約4.3%-5.7%慢性乙肝患者會(huì)受到HDV感染���。
Lambda是“first-in-class”III型干擾素(type III IFN)����,能在病毒感染期間刺激免疫應(yīng)答,達(dá)到保護(hù)宿主的目的���。與IFNα所靶向的I型IFN受體不同���,Lambda靶向的是III型IFN受體。這些III型受體在肝細(xì)胞上高度表達(dá)���,但在造血和中樞神經(jīng)系統(tǒng)細(xì)胞表達(dá)有限����,這可能減少脫靶效應(yīng)并提高Lambda的耐受性����。Lambda此前已經(jīng)在3000多個(gè)患者中進(jìn)行了臨床試驗(yàn)。它已經(jīng)獲得FDA授予的孤兒藥資格和快速通道資格���。
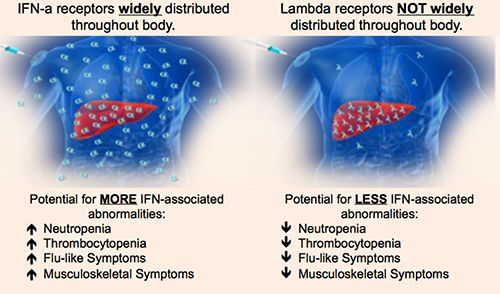
▲Lambda受體和IFNα受體在體內(nèi)分布的區(qū)別(圖片來(lái)源:Eiger公司官網(wǎng))
這項(xiàng)突破性療法認(rèn)定是基于Lambda在2期臨床試驗(yàn)LIMT(Lambda Interferon Mono Therapy)中33例HDV感染患者的表現(xiàn)���。試驗(yàn)結(jié)果表明,在接受治療24周之后���,患者的持久病毒學(xué)緩解率(durable virologic response)達(dá)到36%����。這一數(shù)值優(yōu)于歷史上聚乙二醇化IFNα的表現(xiàn)���。Eiger公司總裁兼首席執(zhí)行官David Cory先生表示:“這一突破性療法認(rèn)定是本公司獲得的第四項(xiàng)突破性療法認(rèn)定���。我們期待與FDA共同合作,加快包括使用lonafarnib和Lambda治療丁型肝炎在內(nèi)的四個(gè)突破性療法認(rèn)定項(xiàng)目的研發(fā)過(guò)程����。”
參考資料:
[1] Eiger Announces FDA Breakthrough Therapy Designation for Peginterferon Lambda for Treatment of Hepatitis Delta Virus Infection, Retrieved August 20, 2019, from https://www.prnewswire.com/news-releases/eiger-announces-fda-breakthrough-therapy-designation-for-peginterferon-lambda-for-treatment-of-hepatitis-delta-virus-infection-300903974.html
[2] Eiger BioPharmaceuticals. Retrieved August 20, 2019, from http://www.eigerbio.com/



