近日����,羅氏旗下抗流感新藥Baloxavir Marboxil片在中國獲批進(jìn)入臨床(受理號JXHL1900134)��,適應(yīng)癥為預(yù)防甲型或乙型流感繼發(fā)性家庭內(nèi)傳播���。值得注意的是����,這款新藥的上市申請?jiān)幻绹鳩DA授予優(yōu)先審評資格����,去年在美國獲批用于治療12歲及以上、急性(患病時間超過48小時)且無并發(fā)癥的流感患者��,成為近20年來首例被FDA批準(zhǔn)的新型抗病毒流感治療藥物���。
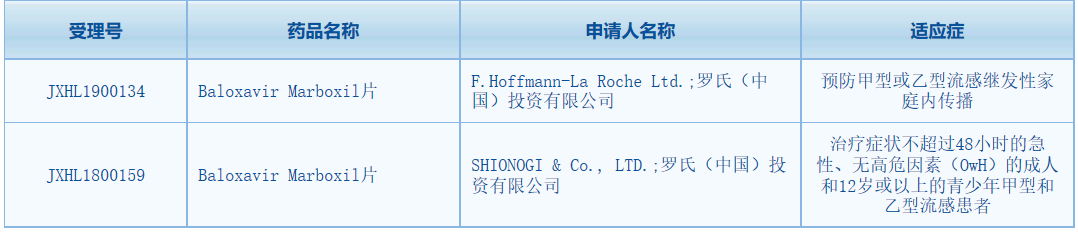
▲數(shù)據(jù)來源:CDE官網(wǎng)
流感是由流感病毒引起的傳染性呼吸道疾病��,屬季節(jié)性多發(fā)疾病����,在學(xué)校、養(yǎng)老院等人群密集的地方極易傳播���。全球每年約有300萬至500萬例嚴(yán)重流感患者���,29萬至60萬患者因流感而死亡。
Baloxavir marboxil是一種核酸內(nèi)切酶抑制劑��,能夠在服藥一天之內(nèi)顯著緩解流感病情����。作為同類首個單劑口服藥物,Baloxavir marboxil的創(chuàng)新作用機(jī)制能夠清除流感病毒����,包括對奧司他韋等具有耐藥性的菌株以及禽流感菌株。

根據(jù)ClinicalTrial提供的數(shù)據(jù)����,2016年12月到2017年4月,Baloxavir marboxil完成了一項(xiàng)隨機(jī)����、雙盲、安慰劑對照的3期臨床試驗(yàn)��,共招募來自日本��、加拿大和美國等地區(qū)的1436名患者��,雙盲��、隨機(jī)分為三組(Baloxavir marboxil組,安慰劑組和奧司他韋組)��。結(jié)果顯示��,與其他兩組患者相比���,服用Baloxavir marboxil的患者的流感癥狀在24小時內(nèi)得到顯著緩解����,且不良反應(yīng)的發(fā)生率都在刻意接受的范圍內(nèi)���。在另一項(xiàng)在1832名患者中展開的安全性和有效性試驗(yàn)中��,Baloxavir marboxil也表現(xiàn)亮眼����。
正是基于該藥物有顯著提高治療、診斷或預(yù)防嚴(yán)重流感的安全性和有效性����,F(xiàn)DA才授予了其優(yōu)先審評資格。值得一提的是���,在FDA批準(zhǔn)之前��,該藥就已經(jīng)于當(dāng)年(2018)2月在日本獲批上市���。

近年來���,中國的流感發(fā)病率和死亡率總體呈陡峭上升趨勢。中國疾病預(yù)防控制中心數(shù)據(jù)顯示��,僅2019年前5個月��,流感上報(bào)發(fā)病病例已達(dá)177萬��,超過了過去四年的流感上報(bào)人數(shù)總和。希望該藥能在中國順利獲批���,為廣大嚴(yán)重流感患者減輕病癥,帶來福音���。





