三陰性乳腺癌(TNBC)是指雌激素受體(ER)���、孕激素受體(PR)和人表皮生長因子受體(HER2)均未表達的乳腺癌���,占所有乳腺癌病例的12%���。其病理學特點表現(xiàn)為組織學分級較高���、發(fā)病年齡較早、腫瘤體積較大��、發(fā)生內臟轉移和骨轉移的幾率較大���。TNBC比非三陰性乳腺癌死亡率更高��,且中位生存期更短��。手術并結合化療���、放療輔助治療是這種癌癥主要的治療手段,目前亟需有效的靶向治療策略���。最近���,美國波士頓兒童醫(yī)院(Boston Children's Hospital)的研究人員首次報道了靶向TNBC腫瘤的CRISPR基因編輯療法。他們將CRISPR系統(tǒng)封裝在納米脂質凝膠顆粒中���,注入小鼠體內后可敲除其致癌基因��,在選擇性識別癌細胞的同時可保留正常組織��,從而達到抑制腫瘤生長的目的���。相關工作發(fā)表在《美國科學院院刊》(PNAS)上��。

CRISPR基因編輯技術在基礎科學研究中炙手可熱��,但迄今為止��,開發(fā)合適的遞送體系將其轉化為有效的疾病治療手段仍然是一個挑戰(zhàn)���。以往人們曾設想使用病毒作為載體,但病毒的負載能力有限���,并且一旦感染靶標以外的細胞��,可能會帶來嚴重的毒副作用��,另一種方法則是將CRISPR系統(tǒng)封裝在陽離子聚合物或脂質納米顆粒內���,但相應的載體可能產(chǎn)生細胞毒性��,表達CRISPR系統(tǒng)的轉基因序列也可能會在到達靶標細胞前被捕獲或分解。本文作者則將表達CRISPR系統(tǒng)的轉基因封裝在納米脂質凝膠中���,這種載體由脂肪分子和水凝膠組成��,無毒��、具有良好的柔性和彈性��,可與靶向細胞的細胞膜融合���,并有效遞送攜帶的DNA序列。該方法將CRISPR系統(tǒng)封裝在偶聯(lián)了特定抗體的納米脂質凝膠顆粒中��,這種抗體可特異性識別TNBC細胞的靶點ICAM-1蛋白���,從而將CRISPR系統(tǒng)引導至腫瘤部位��,達到治療的目的��。
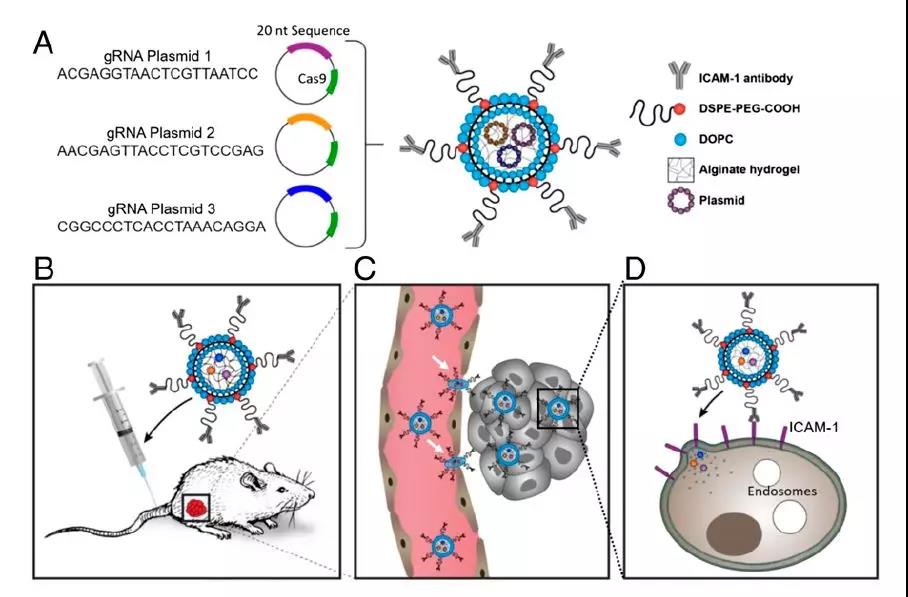
▲納米顆粒遞送CRISPR系統(tǒng)示意圖(圖片來源:參考資料[1])
作者設計了小鼠模型試驗���,通過這種方法,CRISPR系統(tǒng)可有效遞送至其乳腺腫瘤細胞���,并敲除乳腺癌驅動基因之一LCN2���,腫瘤細胞組織的基因敲除效率達到81%���,腫瘤生長速率降低了77%,與此同時���,正常的細胞組織沒有受到明顯的影響��。該工作的通訊作者Marsha A. Moses博士還表示���,這種方法在TNBC的靶向治療中初步取得積極的結果,在其他類型的癌癥治療中應該也可以大顯身手���,目前研究團隊正在探索這一技術在其它癌癥種類中的應用���。
參考資料
[1] Peng Guo et al., (2019). Therapeutic genome editing of triple-negative breast tumors using a noncationic and deformable nanolipogel. PNAS, DOI: 10.1073/pnas.1904697116
[2] CRISPR gene editing may halt progression of triple-negative breast cancer. Retrieved Aug. 28, 2019, from https://www.eurekalert.org/pub_releases/2019-08/bch-cge082219.php



