近日,英國(guó)胃腸病學(xué)會(huì)(BSG)的官方期刊Gut發(fā)表了伏諾拉生(又稱(chēng)沃諾拉贊)亞洲多中心臨床研究的3期數(shù)據(jù)��,該研究證實(shí)了伏諾拉生相對(duì)于蘭索拉唑用于治療亞洲反流性食管炎患者的非劣效性以及兩者相似的安全性��。目前��,伏諾拉生并未在中國(guó)獲批上市��,不過(guò)武田制藥(Takeda)已向中國(guó)國(guó)家藥監(jiān)局遞交了2項(xiàng)該藥的上市申請(qǐng)��,且均被納入優(yōu)先審評(píng)��。
反流性食管炎是由胃��、十二指腸內(nèi)容物反流入食管引起的食管炎癥性病變��,內(nèi)鏡下表現(xiàn)為食管黏膜的破損��,即食管糜爛和(或)食管潰瘍��。數(shù)據(jù)顯示��,中國(guó)人群反流性食管炎的發(fā)病率高達(dá)6.4%��,而在有消化道癥狀的人群中��,有高達(dá)17.8%的患者經(jīng)胃鏡證實(shí)為反流性食管炎��。
質(zhì)子泵抑制劑(PPI)是目前治療反流性食管炎的有效藥物之一��,但傳統(tǒng)的PPI療法存在諸多弱點(diǎn)��。包括半衰期短��,在酸性環(huán)境中易被破壞��,僅抑制活化的質(zhì)子泵��,在達(dá)到完全效果之前需要3到5個(gè)周期的給藥等��。此外��,有部分患者PPI治療效果不是很理想��,需要新的治療手段��。
▲圖片來(lái)源:123RF
伏諾拉生是一種新型鉀離子競(jìng)爭(zhēng)性酸阻滯劑又稱(chēng)為P-CAB��,它能夠在胃壁細(xì)胞胃酸分泌的最后一步中��,通過(guò)抑制K+對(duì)H/K-ATP酶(質(zhì)子泵)的結(jié)合作用��,提前終止胃酸的分泌��。該藥具有親脂性��、弱堿性、解離常數(shù)高和在低pH值時(shí)穩(wěn)定的特點(diǎn)��,因此具有速效��、強(qiáng)勁��、持久的抑制胃酸分泌作用��。 由于伏諾拉生半衰期長(zhǎng)��,作用時(shí)間更持久��,因此被視為一種有效的長(zhǎng)效PPI��。2014年12月��,伏諾拉生在日本獲批��,用于治療胃和十二指腸潰瘍��,反流性食管炎和預(yù)防復(fù)發(fā)��,二次預(yù)防小劑量阿司匹林或非甾體類(lèi)抗炎藥誘導(dǎo)的胃粘膜損傷��,以及用于一線和二線幽門(mén)螺桿菌根除治療��。此次在期刊上發(fā)表的是一項(xiàng)在亞洲4個(gè)國(guó)家和地區(qū)(中國(guó)大陸��、中國(guó)臺(tái)灣��、馬來(lái)西亞及韓國(guó))的56家中心進(jìn)行的隨機(jī)��、雙盲��、雙模擬��、平行組��、多中心研究��。受試者根據(jù)反流性食管炎患者黏膜損傷程度進(jìn)行分層��,并按照1:1的比例隨機(jī)分組��,接受每日1次口服伏諾拉生20mg或每日1次口服蘭索拉唑30mg的治療��,持續(xù)8周��。主要終點(diǎn)為8周的黏膜愈合率��,次要終點(diǎn)為2周和4周的黏膜愈合率��。安全性終點(diǎn)包括治療突發(fā)不良事件(TEAEs)。治療結(jié)果顯示��,伏諾拉生組與蘭索拉唑組患者8周黏膜愈合率分別為92.4%與91.3%��;2周的黏膜愈合率分別為75.0%和67.8%��;4周的黏膜愈合率分別為85.3%和83.5%��。在LA C/D分層的患者中��,伏諾拉生組2周��、4周和8周的黏膜愈合率分別為62.2%��、73.3%��、84.0%��,均高于蘭索拉唑組的51.5%��、67.2%��、80.6%��。值得一提的是��,傳統(tǒng)PPI在LA C/D級(jí)RE患者黏膜愈合率不足8成��。在安全性方面��,伏諾拉生組與蘭索拉唑組的TEAEs發(fā)生率分別為38.1%和36.6%��。表明20mg伏諾拉生每日一次的安全性與30mg蘭索拉唑每日一次的安全性相似��。該研究證實(shí)了伏諾拉生相對(duì)于蘭索拉唑用于治療亞洲反流性食管炎患者的非劣效性以及兩者相似的安全性��。同時(shí)也為伏諾拉生可用于治療中國(guó)反流性食管炎患者提供了臨床證據(jù)��。值得一提的是��,武田制藥曾在2018年10月向中國(guó)國(guó)家藥典委員會(huì)提交了TAK-438片中文通用名稱(chēng)的命名申請(qǐng)��,并正式確認(rèn)為富馬酸伏諾拉生片��,英文名稱(chēng)為vonoprazan fumarate tablets��。此前��,該藥在中國(guó)被稱(chēng)為沃諾拉贊��。
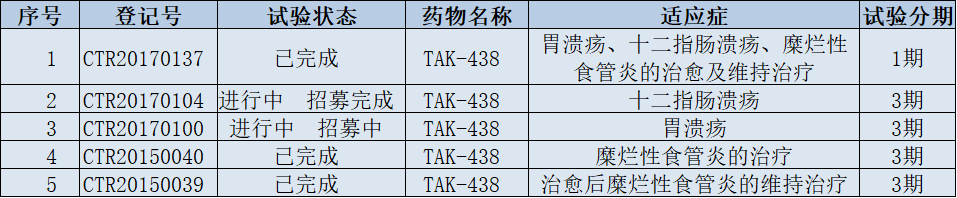
▲伏諾拉生中國(guó)臨床試驗(yàn)一覽(數(shù)據(jù)來(lái)源:藥物臨床試驗(yàn)登記與信息公示平臺(tái))
在臨床試驗(yàn)方面,武田制藥在中國(guó)登記開(kāi)展了5項(xiàng)研究����,包括4項(xiàng)3期臨床試驗(yàn)��。適應(yīng)癥包括十二指腸潰瘍��、胃潰瘍���、糜爛性食管炎等。目前����,伏諾拉生尚未在中國(guó)獲批上市,不過(guò)武田制藥已向中國(guó)國(guó)家藥監(jiān)局遞交了2項(xiàng)上市申請(qǐng)��,且均被納入優(yōu)先審評(píng)��。在原研產(chǎn)品尚未獲批進(jìn)口的情況下,中國(guó)也有了多家企業(yè)的仿制藥正在開(kāi)展生物等效性試驗(yàn)����,包括正大天晴���、中美華東制藥等��。我們祝賀武田這款產(chǎn)品在臨床研究中取得新進(jìn)展���,期待這款新藥能早日獲批,從而造福更多患者����。





