今日��,研究神經(jīng)疾病再生醫(yī)學的SanBio公司宣布��,美國FDA授予其SB623再生醫(yī)學先進療法認定(RMAT),用于治療創(chuàng)傷性腦損傷(TBI)引起的慢性神經(jīng)退行性運動障礙��。今年4月�,SB623已經(jīng)獲得日本的先驅(qū)藥品認定(SAKIGAKE)。
TBI包括腦震蕩和銳器對大腦的損傷��,可能由多種原因產(chǎn)生,最常見的原因包括汽車事故�,摔倒和運動相關損傷。據(jù)統(tǒng)計��,其發(fā)生頻率超過中風和心臟病的發(fā)生率總和��。TBI是導致殘疾的重要原因�,而且是年輕人中的首要致死因素��。TBI可能會引起很多種腦損傷��,包括中樞神經(jīng)系統(tǒng)功能障礙��,腦血管功能紊亂�,以及慢性神經(jīng)退行性運動障礙等等,嚴重影響患者的生活質(zhì)量��。
SB623是一種再生細胞藥物�,由來自成體骨髓的間充質(zhì)干細胞組成,并經(jīng)過遺傳修飾��。它是一種基于干細胞的療法��,具有促進腦組織再生的潛力�,可幫助缺血性卒中或TBI患者在受傷部位周圍區(qū)域恢復功能�。在使用SB623治療缺血性中風小鼠模型的動物研究中��,觀察到神經(jīng)干細胞向損傷部位遷移��,神經(jīng)細胞增殖和血管生成等現(xiàn)象�。SB623除了在治療神經(jīng)系統(tǒng)疾病中得到應用,SanBio公司還將SB623的研發(fā)管線擴展到炎癥性疾病和癌癥領域�。SanBio公司預計將在2021年1月底開始進行SB623治療由TBI引起的慢性神經(jīng)退行性運動障礙的3期試驗。
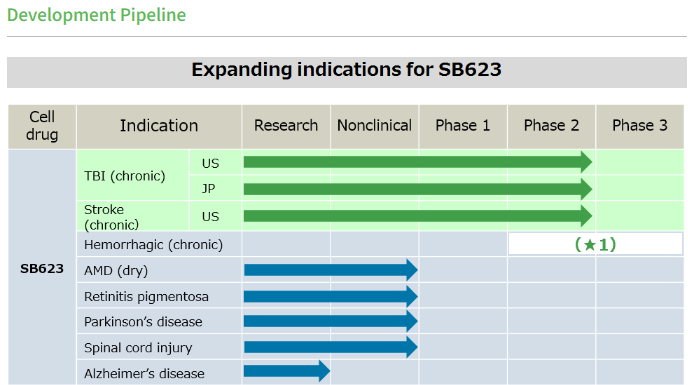
▲SB623研發(fā)管線(圖片來源:SanBio官網(wǎng))
該認定是基于一項名為STEMTRA的隨機�,雙盲,含假手術對照組的2期臨床研究��,共有61名患者參與這一為期12個月的試驗��。該研究旨在評估�,與假手術對照組相比,SB623在治療由TBI引起的慢性神經(jīng)退行性運動障礙患者中的療效和安全性�。其主要研究終點是患者6個月時的運動損傷與基線比較的平均變化,并通過Fugl-Meyer運動功能量表(FMMS)的評分來比較�。研究結果表明,接受SB623治療的患者FMMS評分較基線的平均改善顯著高于對照組�,達到試驗的主要終點。在接受SB623治療的患者中��,F(xiàn)MMS評分較基線平均改善8.3個點�,而在對照組中的這一數(shù)字為2.3個點�。其中39.1%接受SB623治療的患者FMMS評分達到至少10分��,而在對照組中��,只有6.7%的患者達到�。
“SB623的再生醫(yī)學先進療法認定是SanBio公司發(fā)展中的一個重要里程碑。SB623對于因TBI導致的慢性神經(jīng)退行性運動障礙患者來說�,提供了一種新的治療選擇�,”SanBio公司首席醫(yī)學官兼研究負責人Bijan Nejadnik說:“TBI常伴有長期的并發(fā)癥或會導致死亡,是全球最常見的疾病狀況之一�。我們期待與FDA繼續(xù)合作,推動SB623的進一步研發(fā)��,解決這一嚴重未被滿足的醫(yī)療需求�。“
參考資料:
[1] SanBio Granted Regenerative Medicine Advanced Therapy Designation from the U.S. FDA for SB623 for the Treatment of Chronic Neurological Motor Deficits Secondary to Traumatic Brain Injury,Retrieved September 19, 2019, from https://www.businesswire.com/news/home/20190918006094/en/



