日前����,美國FDA宣布�����,批準(zhǔn)Clinuvel公司開發(fā)的Scenesse(afamelanotide)上市�����,治療因為紅細胞生成性原卟啉?���。╡rythropoietic protoporphyria)而出現(xiàn)皮膚損傷的成年患者�����,降低他們曝露在陽光下時可能出現(xiàn)的皮膚疼痛和損傷。FDA的新聞稿表示����,這是第一款獲批提高這些患者無痛陽光曝露時間的療法����。
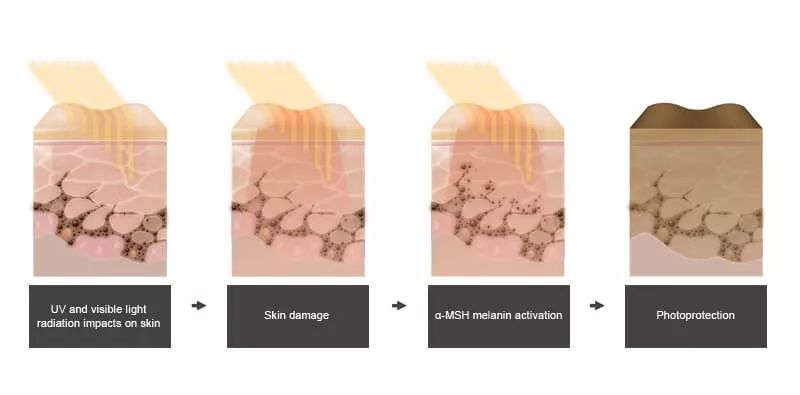
紅細胞生成性原卟啉病是一種由于表達鐵螯合酶的基因出現(xiàn)突變而引起的罕見疾病。鐵螯合酶在血紅素生成中起到重要作用����。鐵螯合酶活性的降低導(dǎo)致身體中原卟啉IX聚集(PPIX),而陽光與皮膚中的PPIX相互作用會引起皮膚的嚴(yán)重疼痛和紅腫�����。患者需要采取特別措施避免陽光曝露�����。Afamelanotide是一種黑皮質(zhì)素-1受體激動劑����。它是一種合成多肽�����,是α-黑色素細胞刺激激素(α-MSH)的類似物����。α-MSH是人體中天然產(chǎn)生的多肽類激素����。它在紫外線的刺激下由皮膚細胞釋放。α-MSH能夠刺激黑色素細胞生成和釋放黑色素����,而黑色素具有保護皮膚不受光照損傷的效果。Afamelanotide將α-MSH中的兩個氨基酸進行了替換�����,提高了分子的穩(wěn)定性和效力����。它可以在皮膚不受紫外線照射的情況下,增加皮膚的黑色素水平�����。這款療法曾經(jīng)獲得美國FDA授予的孤兒藥資格和優(yōu)先審評資格。Afamelanotide的療效在兩項臨床試驗中得到驗證����。在其中一項試驗中,總計93名紅細胞生成性原卟啉病患者參加了試驗�����,48名患者接受了afamelanotide的治療�����。試驗結(jié)果表明�����,在接受治療的180天中����,afamelanotide組患者無痛陽光曝露時間總計64個小時�����,顯著高于安慰劑組(41個小時)�����。“對于紅細胞生成性原卟啉病患者來說,曝露在陽光下可能非常疼痛����。在這一批準(zhǔn)之前,沒有FDA批準(zhǔn)的療法能夠幫助他們提高陽光曝露時間�����,”FDA藥物評估和研究中心藥物評估III辦公室主任Julie Beitz博士說:“這一批準(zhǔn)是FDA致力于鼓勵醫(yī)藥行業(yè)開發(fā)治療罕見病的創(chuàng)新療法的體現(xiàn)�����。與藥物開發(fā)商合作�����,我們能夠?qū)?chuàng)新療法安全和有效地帶給患者�����。”
參考資料:
[1] FDA approves first treatment to increase pain-free light exposure in patients with a rare disorder. Retrieved October 8, 2019, from https://www.prnewswire.com/news-releases/fda-approves-first-treatment-to-increase-pain-free-light-exposure-in-patients-with-a-rare-disorder-300934079.html
[2] Clinuvel. Retrieved October 8, 2019, from https://www.clinuvel.com/