今日�,Mirum Pharmaceuticals公司宣布,美國FDA授予其選擇性ASBT抑制劑maralixibat突破性療法認(rèn)定�,用于治療1歲及以上Alagille綜合癥(ALGS)兒童患者的瘙癢癥狀��。該療法在治療ALGS兒童患者的2b期臨床試驗(yàn)中,顯著降低了患者的血清膽汁酸(sBA)水平�,并改善患者的瘙癢癥狀。此前�,F(xiàn)DA已授予maralixibat突破性療法認(rèn)定,用于治療2型進(jìn)行性家族性肝內(nèi)膽汁淤積癥(PFIC)患者��。
ALGS是一種使人衰弱的罕見遺傳疾病�,主要侵襲兒童患者。該疾病患者的膽管先天性發(fā)育不良��,導(dǎo)致膽汁在肝臟內(nèi)積累�,阻止肝臟正常工作,進(jìn)而導(dǎo)致進(jìn)行性肝病發(fā)生��。ALGS可累及肝臟,心臟��,腎臟和中樞神經(jīng)系統(tǒng)等身體器官��。15%-47%的患者最終需要進(jìn)行肝移植��。嚴(yán)重瘙癢是該疾病的主要特征�,也是所有慢性肝病中最嚴(yán)重的瘙癢癥,在3歲左右的患者中最為常見�。ALGS嚴(yán)重影響患者的生活,具有高度未被滿足的治療需求�。Maralixibat是一種口服的選擇性頂端鈉依賴性膽汁酸轉(zhuǎn)運(yùn)蛋白(ASBT)抑制劑。ASBT存在于小腸內(nèi)��,它介導(dǎo)腸內(nèi)膽汁酸的吸收��,并幫助其循環(huán)回肝臟�。Maralixibat可以使更多的膽汁酸隨糞便排出,防止過量膽汁酸積累��,控制與膽汁淤積性肝病相關(guān)的極度瘙癢��。目前��,maralixibat正在臨床試驗(yàn)中治療ALGS和PFIC��。
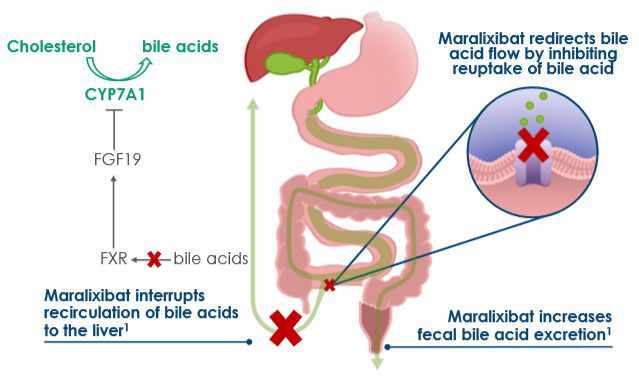
▲Maralixibat的工作機(jī)理示意圖(圖片來源:參考資料[2])
該療法的認(rèn)定是基于一項(xiàng)名為ICONIC的雙盲,含安慰劑對照組的2b期臨床試驗(yàn)數(shù)據(jù)��。該試驗(yàn)結(jié)果顯示�,與安慰劑相比,接受maralixibat治療的ALGS兒童患者的sBA水平較基線時顯著下降�。此外��,患者的瘙癢(ItchRO)評分�,瘙癢劃傷指數(shù)(CSS)等指標(biāo)也得到了改善。
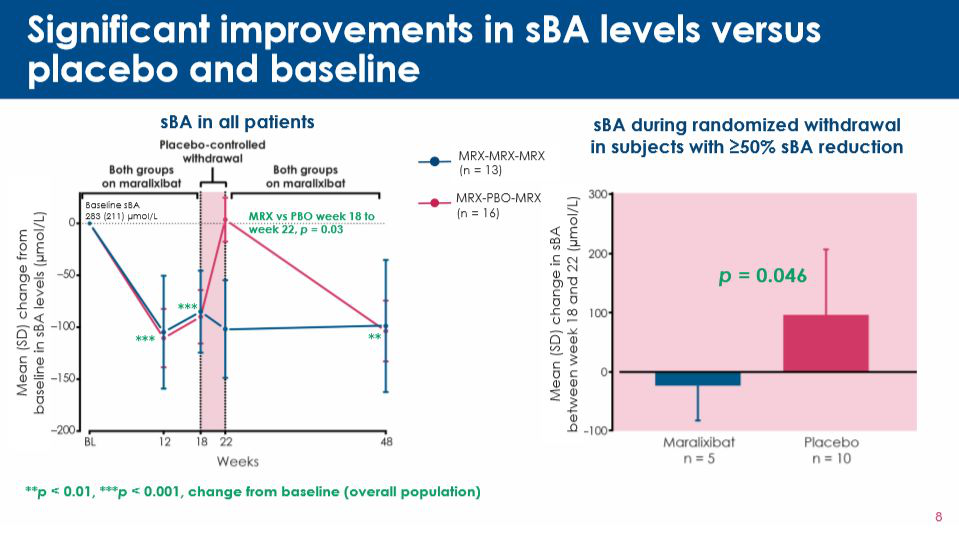
▲Maralixibat顯著改善患者的sBA(圖片來源:參考資料[2])
我們期待突破性療法認(rèn)定能夠進(jìn)一步加快這款創(chuàng)新療法的開發(fā)��,早日將它帶到患者身邊�。
參考資料:
[1] Mirum Pharmaceuticals Announces Breakthrough Therapy Designation for Maralixibat for the Treatment of Pruritus Associated with Alagille Syndrome, Retrieved October 28, 2019, from https://www.businesswire.com/news/home/20191028005198/en
[2] Phase 2 placebo-controlled withdrawal study of the ASBT inhibitor maralixibat in children with Alagille syndrome, Retrieved October 28, 2019, from https://mirumpharma.com/wp-content/uploads/2019/07/ICONIC304_EASL2019_oral_presentation_final.pdf




