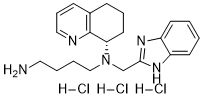
11月12日�,X4 Pharmaceuticals宣布FDA授予mavorixafor (X4P-001)治療WHIM綜合征“突破性療法”資格����。WHIM綜合征是趨化因子受體4型(CXCR4)基因突變引起的一種罕見的遺傳性原發(fā)性自身免疫缺陷疾病,表現(xiàn)為疣�、低丙種球蛋白血癥、細(xì)菌感染以及無效生成性慢性粒細(xì)胞缺乏的四聯(lián)癥�����。WHIM綜合征患者在嬰幼兒早期死亡率較高�,一生當(dāng)中有較高的反復(fù)發(fā)作致命性感染的風(fēng)險?����;颊咄瑫r容易罹患HPV病毒相關(guān)的宮頸癌和淋巴瘤����,總體癌癥風(fēng)險達(dá)30%~40%。目前無任何針對該病的治療藥物獲批�����,標(biāo)準(zhǔn)治療方案是使用抗生素治療急性感染����,或者用免疫球蛋白替代療法或G-CSF用于預(yù)防感染。目前也尚無WHIM綜合征的準(zhǔn)確發(fā)病率數(shù)據(jù)�����,美國大約有15000~100000例不明原因的原發(fā)性免疫缺陷疾病患者,WHIM綜合征只是其中病因之一�����。Mavorixafor是一款全球領(lǐng)先的first-in-class口服CXCR4拮抗劑����,在WHIM綜合癥臨床II期試驗中獲得成功 ,于2018年被FDA授予孤兒藥資格�����,于2019年獲得歐盟授予的孤兒藥資格����,目前已啟動全球III期臨床試驗。
FDA授予其突破性療法資格�����,主要基于一項在成人WHIM綜合征患者中進(jìn)行的開放標(biāo)簽�、多中心、II期“概念性驗證”研究的數(shù)據(jù)�����,發(fā)現(xiàn)Mavorixafor治療可以提供具有臨床意義的中性粒細(xì)胞絕對數(shù)(ANCs)�、淋巴細(xì)胞絕對數(shù)(ALCs)改善,意味著患者感染風(fēng)險和疣負(fù)擔(dān)降低�����。而且Mavorixafor具有良好的耐受性�����。今年7月16日����,和譽生物宣布與X4 Pharmaceuticals達(dá)成協(xié)議,獲得mavorixafor在大中華地區(qū)的開發(fā)與商業(yè)化達(dá)成獨家合作協(xié)議����,并將主導(dǎo)其大中華地區(qū)多個腫瘤適應(yīng)癥的臨床與商業(yè)開發(fā),啟動多項mavorixofor與腫瘤免疫抑制劑或其它藥物聯(lián)合治療的臨床研究�����。10月24日�,和譽生物宣布與君實生物達(dá)成協(xié)議�����,雙方將就Mavorixafor聯(lián)合特瑞普利單抗治療三陰性乳腺癌在中國進(jìn)行臨床探索和開發(fā)�。X4還在對mavorixafor進(jìn)行針對其它多種適應(yīng)癥的臨床開發(fā)�。在多項腫瘤臨床I/II期試驗中,觀察到單藥及與PD-1單抗或其它腫瘤藥物聯(lián)用時良好的安全性及藥效�����。