日前羅氏(Roche)宣布�����,美國(guó)FDA已接受risdiplam的新藥上市申請(qǐng)(NDA)�����,并授予其優(yōu)先審評(píng)資格�����。Risdiplam是一種用于治療脊髓性肌萎縮癥(SMA)的SMN2基因的mRNA剪接修飾劑�����。Risdiplam旨在增加和維持整個(gè)中樞神經(jīng)系統(tǒng)和身體外周組織的SMN蛋白水平�����。預(yù)計(jì)FDA將在2020年5月24日前做出批準(zhǔn)決定�����。此前�����,F(xiàn)DA于2017年1月授予risdiplam孤兒藥資格認(rèn)定,隨后于2017年4月授予快速通道資格認(rèn)定�����。如果獲得批準(zhǔn)�����,risdiplam將成為首個(gè)用于治療SMA患者的口服用藥�����。SMA的發(fā)病根源在于一種被稱(chēng)為運(yùn)動(dòng)神經(jīng)元生存蛋白(survival motor neuron, SMN)的缺失或失常�����。患者運(yùn)動(dòng)神經(jīng)元迅速死亡�����,肌肉功能逐步喪失�����,最終導(dǎo)致癱瘓�����,且無(wú)法完成吞咽�����、呼吸等維持生命的基本活動(dòng)�����,嚴(yán)重威脅患者生命�����。雖然SMA主要是在嬰幼兒期發(fā)病�����,但患者可能是從嬰兒至成人的任何年齡段�����,臨床上通常分為1型�����,2型和3型SMA,即嬰兒型�����,中間型和成年型SMA�����。目前獲批上市的SMA治療藥物有渤?����。˙iogen)的Spinraza和諾華(Novartis)的基因療法Zolgensma�����。Risdiplam是由羅氏旗下基因泰克(Genentech)公司和PTC Therapeutics公司�����,以及SMA基金會(huì)聯(lián)合開(kāi)發(fā)的一款口服SMN2基因剪接調(diào)節(jié)劑�����。它通過(guò)調(diào)節(jié)SMN2基因的剪接過(guò)程,提高SMN蛋白在中樞神經(jīng)系統(tǒng)(CNS)和外周的表達(dá)�����。這一治療SMA的策略與已經(jīng)獲批的Spinraza非常相似�����。不同之處在于Spinraza是使用反義寡核苷酸(ASO)調(diào)節(jié)RNA剪接�����,需要直接注射到腦脊液中�����。而risdiplam是一款小分子藥物�����,可以口服使用�����。
Risdiplam的NDA申請(qǐng)基于FIREFISH和SUNFISH關(guān)鍵性研究結(jié)果�����。FIREFISH是一項(xiàng)在41例1型SMA嬰兒中評(píng)價(jià)risdiplam的關(guān)鍵性�����、單臂試驗(yàn)�����。SUNFISH是一項(xiàng)雙盲�����、含安慰劑對(duì)照的關(guān)鍵性臨床試驗(yàn)�����,在2型或3型SMA兒童和年輕成人(2-25歲)中開(kāi)展�����。Risdiplam在這兩項(xiàng)試驗(yàn)中均展現(xiàn)出積極的臨床療效�����。迄今為止,在任何risdiplam試驗(yàn)中均未觀察到導(dǎo)致研究退出的治療相關(guān)安全性事件�����。
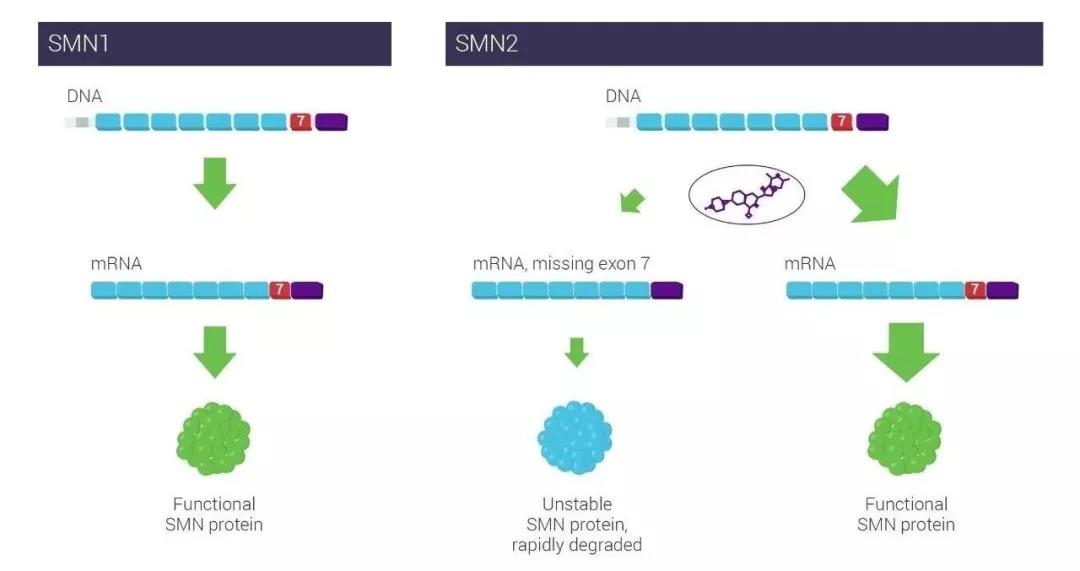
▲Risdiplam通過(guò)調(diào)節(jié)SMN2 RNA剪接提高SMN蛋白水平(圖片來(lái)源:PTC Therapeutics公司官網(wǎng))羅氏首席醫(yī)學(xué)官兼全球產(chǎn)品開(kāi)發(fā)負(fù)責(zé)人Levi Garraway博士說(shuō):“FIREFISH和SUNFISH試驗(yàn)的設(shè)計(jì)代表真實(shí)世界的SMA患者�����,包括許多以前在臨床試驗(yàn)中代表不足的患者群體�����。我們期待與FDA密切合作�����,為所有可能受益的患者探索廣泛使用risdiplam的途徑�����。”
參考資料:
[1] FDA grants priority review to Roche’s risdiplam for spinal muscular atrophy. Retrieved 2019-11-25, from https://ml-eu.globenewswire.com/Resource/Download/1fca67b4-c501-4471-99a5-f617a35f7a49

