日前��,Myovant Sciences公司宣布���,該公司為創(chuàng)新療法relugolix遞交的新藥申請(NDA)已被美國FDA接受,適應(yīng)癥為男性晚期前列腺癌患者��。FDA同時授予這一NDA優(yōu)先審評資格���,預(yù)計(jì)在今年12月20日之前做出回復(fù)��。FDA在受理函中還表示��,目前不計(jì)劃為這一申請召開咨詢委員會會議���。如果獲批,relugolix將成為首個也是唯一一個治療晚期前列腺癌患者的口服促性腺激素釋放激素(GnRH)受體拮抗劑��。
前列腺癌是世界上男性最常見的第二大癌癥��。據(jù)估計(jì)��,在2018年��,有120萬的新患者���,同時大約有36萬患者因此而去世���。前列腺癌是導(dǎo)致男性癌癥死亡的第5大原因���。對于去勢敏感性前列腺癌患者來說,標(biāo)準(zhǔn)治療方法包括促性腺激素釋放激素(GnRH)激動劑醋酸亮丙瑞林(leuprolide acetate)���。但這種療法可能會引起睪丸激素水平的短暫性升高���,加劇臨床癥狀��,且停藥后會延緩睪丸激素水平的恢復(fù)��。Relugolix是一款口服的GnRH受體拮抗劑���,可以結(jié)合并阻斷垂體前葉中的GnRH受體��,減少促黃體生成激素(LH)和卵泡刺激素(FSH)的釋放���,從而降低女性卵巢生成的雌激素水平和男性睪丸激素的產(chǎn)生。Myovant Sciences正在開發(fā)治療晚期前列腺癌的relugolix單藥片劑和治療子宮肌瘤的relugolix組合片劑��。今年5月��,Myovant Sciences已經(jīng)遞交relugolix組合片劑治療子宮肌瘤的新藥申請。
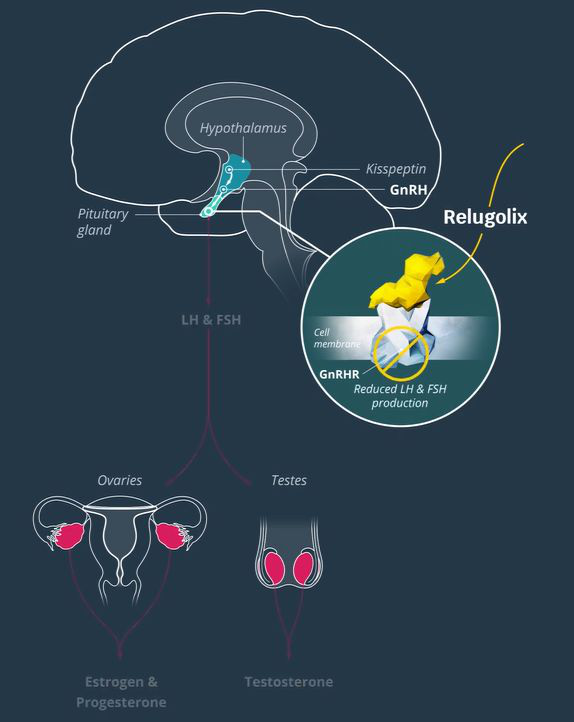
▲Relugolix的作用機(jī)制示意圖(圖片來源:Myovant Sciences官網(wǎng))
這一申請獲得一項(xiàng)隨機(jī)��、開放標(biāo)簽��、平行組3期臨床試驗(yàn)數(shù)據(jù)的支持���?�?傆?jì)900多名雄激素敏感性晚期前列腺癌男性患者接受了relugolix或醋酸亮丙瑞林的治療���。試驗(yàn)結(jié)果表明,relugolix達(dá)到了主要療效終點(diǎn)��,接受relugolix治療的男性中96.7%在48周內(nèi)睪酮持續(xù)抑制水平達(dá)到去勢水平(<50 ng/dL)���,而接受醋酸亮丙瑞林治療的男性中88.8%達(dá)到這一水平��。在安全性方面���,與醋酸亮丙瑞林組男性相比,relugolix組男性發(fā)生主要不良心血管事件(MACE)的風(fēng)險降低54%���。在報(bào)告有MACE病史的男性中���,relugolix組報(bào)告的MACE事件比醋酸亮丙瑞林組少80%(分別為3.6%和17.8%)���。Myovant Sciences公司首席執(zhí)行官Lynn Seely博士說:“我們很高興FDA接受了我們?yōu)閞elugolix遞交的新藥申請,并且授予其優(yōu)先審評資格��。這使我們離為晚期前列腺癌患者提供每日一次的口服新治療選擇又進(jìn)了一步��?��!?/span>
參考資料:
[1] Myovant Sciences Announces Priority Review and FDA Acceptance of New Drug Application for Once-Daily, Oral Relugolix for Advanced Prostate Cancer. Retrieved June 22, 2020, from https://investors.myovant.com/news-releases/news-release-details/myovant-sciences-announces-priority-review-and-fda-acceptance/


