寡核苷酸療法能夠直接調控基因表達,它被認為是繼小分子藥物和蛋白質類藥物之后的新一類藥物開發(fā)熱點方向����。根據(jù)近日發(fā)表在Nature Reviews Drug Discovery期刊上的一篇文章,截止2020年1月�����,全球范圍內已經(jīng)有10款寡核苷酸藥物獲得美國FDA批準上市�,同時還有至少20多款在研寡核苷酸藥物進入臨床研究階段。本文中�,我們將結合發(fā)表在Nature上的這篇文章,以及公開資料�,帶大家了解下寡核苷酸療法的種類,以及當下面臨的主要挑戰(zhàn)和應對策略有哪些����。

圖片來源:123RF
寡核苷酸是一類包含20 個左右堿基的短鏈核苷酸的總稱�����,包括DNA或RNA內的核苷酸。寡核苷酸可通過一系列過程來調節(jié)基因表達��,包括基因沉默��、剪接調節(jié)����、非編碼RNA抑制、基因激活��、基因編輯等等���。因此�����,這類藥物具有治療多種疾病的潛力��。大多數(shù)寡核苷酸通過堿基配對方式與同源目標分子相互作用���。此外,核酸還可以通過形成三維二級結構與蛋白質相互作用����,這一特性也被用于疾病治療藥物的開發(fā)�。例如��,核酸適配體(aptamers)是一種結構核酸配體����,可作為特定蛋白的拮抗劑或激動劑。同樣地��,含有發(fā)夾結構的向導RNA分子也可以與外源引入的Cas9蛋白結合�,并將其引導到特定的基因組DNA位點進行靶向基因編輯。寡核苷酸藥物理論上可以選擇性地靶向任何基因��,且具有最小的��,或至少可預測的脫靶效應�����。此外��,它們也可以靶向罕見疾病患者的特異性基因序列����、特定的等位基因(例如單核苷酸多態(tài)性等)�、致病性融合轉錄本����、傳統(tǒng)的“不可成藥”靶點���,以及對某種寡核苷酸療法產(chǎn)生耐藥性的病毒序列等等�。這些優(yōu)勢和潛力使寡核苷酸成為了當下的研究熱點�。寡核苷酸作為藥物的研究大約始于三十年前。截至2020年1月�����,已有10款寡核苷酸藥物獲得美國FDA批準上市���。寡核苷酸藥物的種類有很多��,包括反義寡核苷酸(ASOs)����、小干擾核糖核酸(siRNA)�����、微小核糖核酸(miRNA)���、核酸適配體等等�。
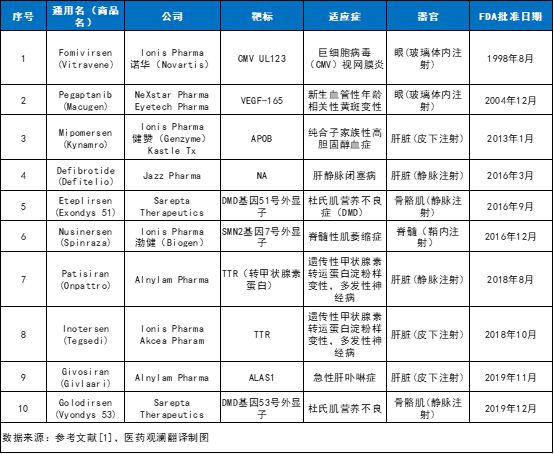
反義寡核苷酸是一種小的����、合成的具有不同化學性質的單鏈核酸聚合物,可通過多種機制調控基因表達����。這類藥物可細分為兩大類: RNase H依賴(RNase H competent)型和空間位阻型(steric block)。內源性RNase H酶Rnase H1識別RNA-DNA異質雙鏈底物��,ASO結合位點的切割導致靶標RNA的破壞�����,從而沉默靶基因的表達�����。新一代的RNase H型ASOs通常遵循“gapmer”模式�,即一個基于DNA的中央“間隙”被基于RNA的側翼區(qū)域包圍,促進目標結合�����。值得注意的是�,Rnase H1在細胞質和細胞核中都是活躍的,因此能夠靶向其他技術可能難以捕捉的核轉錄本�。迄今為止,已經(jīng)有3種 RNase H依賴型ASO藥物獲得批準上市�,分別為fomivirsen、mipomersen和inotersen(見表1)�����。空間位阻寡核苷酸可與目標轉錄本高親和力結合�����,但由于缺乏募集RNase H能力�����,它們不會誘導目標轉錄本降解�����。這類寡核苷酸最廣泛的應用是調節(jié)可變剪接����,以選擇性地排除或保留特定的外顯子�����。然而�,同樣的技術也可以用于剪接破壞�����,即跳過外顯子以中斷目標基因的翻譯�����。此外��,空間位阻寡核苷酸也可能被用于促進異型轉換�����,從而減少有害蛋白異型的表達和/或促進有益蛋白異型的表達�。截至2020年1月,已經(jīng)有3種剪接轉換ASO藥物獲得FDA批準���,分別為eteplirsen��、golodirsen和nusinersen(見表1)�。siRNA是一類雙鏈RNA分子:它的一條鏈成為引導鏈(又稱反義鏈)���,與靶標轉錄物互補;另一條鏈為正義鏈�����。作為RNA誘導沉默復合物(RISC)的一部分���,siRNAs引導Argonaute 2蛋白(AGO2)與目標轉錄本互補�,在AGO2的催化下�,引導鏈的相反位置被切割,進而導致基因沉默����。目前至少兩種siRNAs藥物已獲得FDA批準,分別為patisiran和givosiran�。miRNA是一類由內源基因編碼的非編碼單鏈RNA分子�����,由具有發(fā)夾結構的單鏈RNA前體經(jīng)過Dicer酶加工后生成。miRNA與多種生理和病理過程有關�,包括癌癥、細胞周期進展�、傳染病、免疫���、糖尿病��、新陳代謝���、肌生成和肌肉營養(yǎng)不良,因此成為了新藥開發(fā)的一個重要靶點�����。與siRNA一樣�����,miRNA可以將RNA誘導的沉默復合物(RISC)引導至靶序列�,從而啟動基因沉默。目前����,已有許多公司在開發(fā)miRNA藥物�。例如�����,Regulus公司正在開發(fā)靶向miR-21和miR-17的miRNA寡核苷酸藥物���,擬分別治療Alport腎?����。ˋlport nephropathy)、多囊腎(polycystic kidney disease)����。miRagen公司正在開發(fā)多種miRNA候選藥物:其中cobomarsen是一種靶向miR-155的寡核苷酸抑制劑,擬開發(fā)治療皮膚T細胞淋巴瘤�����;remlarsen是一種靶向miR-29的雙鏈模擬物�����,擬開發(fā)治療瘢痕疙瘩(keloids)�����。許多基因表達長的非編碼RNA�,它們通常與近端蛋白質編碼基因的轉錄抑制有關。用稱為小激活RNA的寡核苷酸片段靶向這些長的非編碼RNA可以逆轉這種負調控的作用�,從而導致轉錄激活,這已在許多疾病相關的基因中得到顯示���,包括BACE1(阿爾茨海默?����。?�、BDNF(帕金森?���。?����、UBE3A(安格曼綜合征)和SCN1A(Dravet綜合征)等等�����。目前,內源性小激活RNA在細胞核內的重要性已經(jīng)越來越受到重視����,作為轉錄基因激活或沉默的天然介質,內源性小激活RNA可能本身就構成了寡核苷酸療法的靶點�。目前,已有許多公司在開發(fā)小激活RNA��。例如�����,MiNA Therapeutics正在開發(fā)MTL-CEBPA�����,這是一種靶向CEBPA(一種參與肝細胞分化和腫瘤抑制的關鍵轉錄因子)的小激活RNA��,以脂質納米顆粒制劑的形式遞送���,用于治療肝細胞癌。目前��,該在研藥正在肝細胞癌和肝硬化患者中開展1期臨床試驗�。激活特定基因的另一種方法是Stoke Therapeutics的TANGO技術平臺��,該技術靶向非生產(chǎn)性RNA剪接以增加基因表達�����,并解決由于基因功能喪失或降低而導致的單基因疾病�。該公司目前的主要候選藥為STK-001���。STK-001是一種反義寡核苷酸藥物��,擬開發(fā)治療Dravet綜合征����。臨床前研究數(shù)據(jù)顯示����,在Dravet綜合征小鼠模型中,STK-001提高了小鼠的生存率�,并降低了癲癇發(fā)作頻率。目前����,該在研藥正在開展1/2a期臨床試驗。

圖片來源:123RF
雖然全球已經(jīng)有十余款寡核苷酸療法獲批上市�����,但寡核苷酸療法的廣泛應用仍面臨一個主要挑戰(zhàn)——如何將寡核苷酸藥物有效輸送到肝臟以外的目標器官和組織。迄今為止����,大多數(shù)寡核苷酸療法,包括幾乎所有已批準的核酸藥物�,都是局部給藥,例如眼睛�����、脊髓�����、肝臟����。寡核苷酸通常是大的親水性多聚陰離子�����,這種特性意味著它們不容易通過質膜�����。由于基于寡核苷酸的治療藥物通常無法穿越血腦屏障(BBB),因此向中樞神經(jīng)系統(tǒng)(CNS)的遞送是一個額外的挑戰(zhàn)�。目前,科學家們正在開發(fā)許多方法和技術����,來解決寡核苷酸藥物遞送這一大難題。化學修飾是增強寡核苷酸藥物遞送的最有效方法之一�,這種方法利用修飾來改善寡核苷酸的藥代動力學、藥效學和生物分布�,以提高藥物的遞送能力。生物偶聯(lián)也是解決寡核苷酸藥物遞送的有效途徑�����。ASOs和siRNA的遞送潛力可以通過直接共價偶聯(lián)不同的“元件”來增強�����,這些“元件”包括脂質�����、肽、適配體����、抗體和糖分子,通過偶聯(lián)可使寡核苷酸更容易接近目標細胞����。納米技術和材料科學的發(fā)展也為解決寡核苷酸藥物遞送的挑戰(zhàn)提供了優(yōu)勢和潛在的解決方案,尤其是針對跨越生物屏障和跨膜細胞內遞送的要求�����。此外�,研究人員也在開發(fā)一些新的技術,如內源性囊泡(即外泌體)�、球型核酸(SNAs)、納米技術(例如DNA籠)和“智能”材料等等�����。寡核苷酸療法的到來�,讓很多疾病的治療成為了可能。許多藥物的獲批表明寡核苷酸藥物的遞送現(xiàn)已成熟�,可臨床用于多種適應癥��。根據(jù)文章,全球范圍內����,目前還有至少20多種在研寡核苷酸療法已在臨床開發(fā)階段,適應癥涉及亨廷頓病�����、阿爾茨海默病��、肌萎縮側索硬化(ALS)����、血友病、肝細胞癌等等��。我們期待��,在科學家���、醫(yī)藥企業(yè)���、患者組織等社會各界的齊心協(xié)力下,寡核苷酸療法的研究可以取得更多的研究和突破�,造福更多患者�����。





