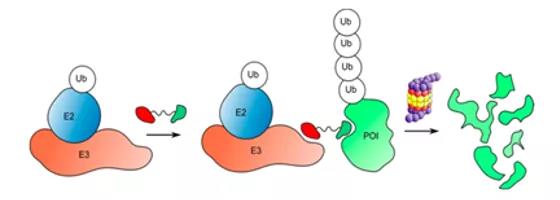
過去十年�����,藥物靶標領(lǐng)域的格局發(fā)生了重大變化。盡管傳統(tǒng)靶標(比如激酶等)依然是主方向���,但是目前風(fēng)向也慢慢從傳統(tǒng)藥物靶標轉(zhuǎn)向更具挑戰(zhàn)性的"不可成藥"靶標。這些靶標通常包括無酶功能的蛋白質(zhì)����,而這些蛋白占據(jù)人體蛋白的80%左右。目前我們所知道的炙手可熱的PROTAC技術(shù)在克服耐藥和靶向不可成藥靶點方面展現(xiàn)出了非常大的潛力��。目前雖然大分子生物藥(單抗�,雙抗,ADC以及干擾素)研發(fā)熱潮一浪高過一浪����,但是并不代表小分子藥物的衰退�����,恰恰相反��,小分子藥物因其獨特的優(yōu)勢(研發(fā)成本相對較低����,工藝相對熟練)���,依然是新藥研發(fā)的主戰(zhàn)場�����,PROTAC技術(shù)作為新興小分子藥物研發(fā)的利器����,有掀起小分子藥物研發(fā)新浪潮的潛能。PROTAC全稱為Proteolysis-Targeting Chimeras��,即蛋白水解靶向嵌合體���,是一種不同于抗體和傳統(tǒng)小分子抑制劑的新型藥物類型���,其結(jié)構(gòu)看起來像啞鈴一樣,通過一個"連接器"(linker)連接"興趣蛋白的配體"以及"E3泛素連接酶的招募配體"�����。也就是說��,PROTAC分子的一端與興趣蛋白(即靶蛋白)結(jié)合���,另一端與E3泛素連接酶結(jié)合����。而E3泛素連接酶可通過將一種叫做泛素的小蛋白貼在靶蛋白上將其標記為缺陷或受損蛋白����。之后,細胞的蛋白粉碎機(即蛋白酶體)會識別和降解被標記的靶蛋白�����?�;谶@種作用機制���,利用PROTAC技術(shù)研發(fā)的藥物也被稱為靶向蛋白降解劑���。 PROTAC分子設(shè)計(Ub:泛素;POI:目標蛋白)(參考文獻2)2001年是PROTAC技術(shù)的元年���,Craig Crews和Raymond Deshaies的團隊在實驗室中實現(xiàn)了利用泛素連接酶E3降解MetAP-2 enzyme���,首次提出了PROTAC這個概念;2003年Crews團隊通過微注射技術(shù)將PROTAC分子注射到一個完整的細胞中����,實現(xiàn)了對雄激素和雌激素受體(AR和ER receptor)的降解,證明了PROTAC技術(shù)在細胞內(nèi)應(yīng)用的可能性����。2004年,在引入一條多肽鏈之后����,首 個可以穿透細胞膜的PROTAC分子被設(shè)計出來���;同年,諾貝爾化學(xué)獎頒給了以色列科學(xué)家Aaron Ciechanover�����、Avram Hershko和美國科學(xué)家Irwin Rose����,以表彰他們在泛素催化的蛋白降解方面做出的貢獻。2008年是一個分水嶺���,之前的PROTAC分子被稱為第一代PROTAC���,作為概念驗證是成功的,但是其弊端也很明顯:需要在相對濃度比較高的情況下工作��,而且多肽鏈的細胞穿透力比較差��。而在2008年���,全部由小分子構(gòu)建的PROTAC藥物模式出現(xiàn)了��,它們對細胞的穿透性很高�,被稱為第二代PROTAC。2013年���,關(guān)于PROTAC的體內(nèi)研究表明PROTAC療法可以抑制腫瘤的生長。此后進一步的研究表明PROTAC可以在非常低的濃度下��,比如納摩爾級濃度下工作���。在2019年���,PROTAC領(lǐng)域的先行者,Arvinas公司推動首 款PROTAC藥物ARV-110 進入了臨床的研究�,這是一款針對男性前列腺癌的藥物。3個月之后��,Arvinas的第二款PROTAC藥物��,針對女性乳腺癌的ARV-471也進入了臨床I期研究�����。近日�,Arvinas宣布這兩款藥物在臨床早期中均取得了積極的結(jié)果�,前景非常光明��。國外:布局PROTACs技術(shù)的初創(chuàng)公司中��,研發(fā)進展最快的是Arvinas(�、C4 Therapeutics、Kymera Therapeutics(靶向IRAK4的蛋白降解劑預(yù)計在2020年上半年開展臨床試驗)等�,除此之外還有Captor therapeutics、nutrix���、Cellida���、Vividion等。這些公司幾乎都受到資本市場的追捧�����。而大公司多以和小型Bio-Tech公司合作為主�,包括基因泰克、輝瑞���、阿斯利康�、默沙東、安進�����、吉利德�����、勃林格殷格翰�����、葛蘭素史克��、新基��、禮來����、艾伯維����、強生等等。國內(nèi):布局PROTACs技術(shù)的初創(chuàng)公司有嘉興優(yōu)博���、上海睿因(Cullgen)����、成都分迪科技、和徑醫(yī)藥��、海創(chuàng)藥業(yè)�、加科思、科倫藥業(yè)�、石藥集團等,都處于研究的早期階段���。其中嘉興優(yōu)博屬于PROTAC的第一梯隊����,擁有差異PROTAC蛋白降解TED平臺���。目前��,嘉興優(yōu)博已經(jīng)有1個藥物準備進入臨床前研究����,預(yù)計融資后18個月申報IND�����。作為一項新技術(shù),PROTAC也存在很多問題亟須解決����,其中,降低分子量�����、縮短linker���,甚至想辦法去掉linker(如開發(fā)分子膠降解劑)是業(yè)界正在努力的重要方向之一。此外��,尋找更多可用的E3泛素連接酶及其結(jié)合物是未來工作的重點之一��。因為��,在≥632個人類E3泛素連接酶中�,約270個被認為與泛素蛋白酶體系統(tǒng)有關(guān),目前只有不到10個被用于靶向蛋白質(zhì)降解���。另一些潛在需要解決的問題包括��,如何改善大規(guī)模生產(chǎn)方案���,提高產(chǎn)率�����,從而降低成本��?如何克服PROTAC的耐藥性�����,即當(dāng)PROTAC分子無法降解某些蛋白突變體時該如何應(yīng)對�?
展望未來3-5年����,一方面,靶向可成藥靶點的PROTAC分子可能會獲批上市����;另一方面,一些靶向不可成藥靶點的PROTAC分子會被開發(fā)出來����,展現(xiàn)出PROTAC技術(shù)真正的優(yōu)勢���,從而為一些目前難以治療的疾病探索新的革命性療法。PROTAC的出現(xiàn)���,為小分子新藥開發(fā)打開了一個廣闊的新世界���。首先,人體內(nèi)有600多種泛素連接酶E3����,目前PROTAC技術(shù)只用到了其中的幾種,巨大的藍海正在等待業(yè)界去探索��。其次�����,PROTAC是一項非常新的技術(shù)�����,而正是由于這個技術(shù)出現(xiàn)的時間很短���,目前只有為數(shù)不多的分子進入臨床研究�,比如前面提及的ARV-110和ARV-471�����,但尚未有產(chǎn)品真正獲批��。這是一個全新的賽道���,生物醫(yī)藥產(chǎn)業(yè)的創(chuàng)新者和創(chuàng)業(yè)者有望在這個領(lǐng)域全新出發(fā)��,目前很多公司正在加碼對PROTAC的研發(fā)投入��,每一個人都可能在下一個拐點來臨之際實現(xiàn)彎道超車�。PROTAC技術(shù)目前主要集中在腫瘤學(xué)領(lǐng)域和神經(jīng)變性疾?�。═au)或炎癥/免疫學(xué)(IRAK4和RIP2K)領(lǐng)域���,取得的初步成果使人們對PROTAC寄予了厚望�,這不僅是化學(xué)生物學(xué)和藥物發(fā)現(xiàn)工具箱中的附加工具��,而且還是成功的治療方式�����。但是PROTAC的開發(fā)仍然存在許多挑戰(zhàn),還需要克服許多其他障礙��,但是路漫漫其修遠兮���,吾將上下而求索�����。1. Dhanusha A. Nalawansha and Craig M. Crews., PROTACs: An Emerging Therapeutic Modality in Precision Medicine, Cell Chemical Biology(2020),DOI:10.1016/j.chembiol.2020.07.020��; 2.G.Burslem and C. Crews, Chem. Rev. 2017. 3.Mariell Pettersson, Craig M. Crews., PROteolysis TArgeting Chimeras (PROTACs) - Past, present and future., Drug Discovery Today: Technologies 2019, 31, 15-27. DOI: 10.1016/j.ddtec.2019.01.002����; 4.https://www.nature.com/articles/nature13527�����; 5.https://pubs.rsc.org/en/content/ebook/978-1-78801-686-5.