今日,美國(guó)FDA宣布����,已授予輝瑞的口服抗新冠病毒藥物Paxlovid緊急使用授權(quán)(EUA),用于治療輕度至中度的新冠疾病患者�����。FDA官方新聞稿指出����,這是首款獲其授權(quán)治療新冠疾病的口服抗病毒藥物。
“今日的授權(quán)帶來(lái)了第一款以藥片形式口服的新冠療法�,這是對(duì)抗這場(chǎng)全球流行病的重要一步,”美國(guó)FDA藥品評(píng)估與研究中心的Patrizia Cavazzoni主任說(shuō)道����,“這項(xiàng)授權(quán)在全新變種出現(xiàn)的關(guān)鍵時(shí)刻,帶來(lái)了抗擊新冠的全新工具�,也讓有高風(fēng)險(xiǎn)發(fā)展為新冠重癥的患者能更容易獲得抗病毒療法。”Paxlovid由兩種主要成分組成:nirmatrelvir(PF-07321332)是一種新冠病毒3CL蛋白酶抑制劑�����,能通過(guò)阻斷新冠病毒3CL蛋白酶的活性�,破壞新冠病毒的后續(xù)RNA復(fù)制過(guò)程。另一種成分ritonavir則讓nirmatrelvir能在身體里保持更長(zhǎng)時(shí)間的活性���,更好地抗擊病毒����。
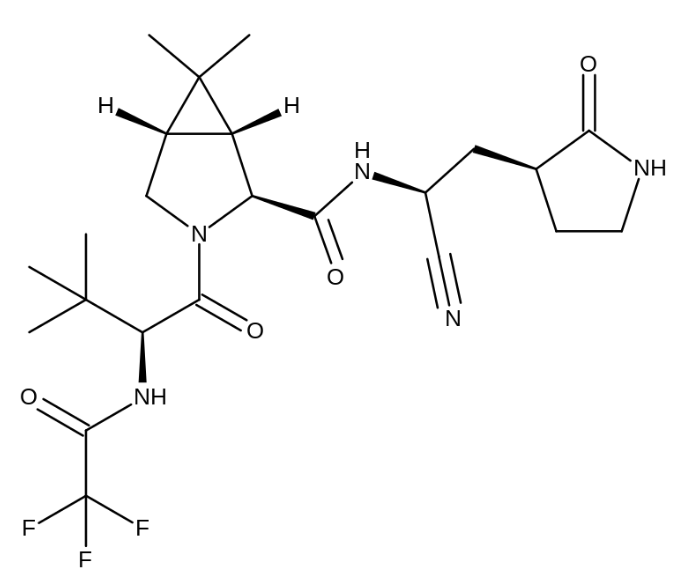
▲Nirmatrelvir分子結(jié)構(gòu)式(圖片來(lái)源:Michael D. Turnbull, CC BY-SA 4.0 <https://creativecommons.org/licenses/by-sa/4.0>, via Wikimedia Commons)支持這一緊急使用授權(quán)的數(shù)據(jù)主要來(lái)自一項(xiàng)隨機(jī)�、雙盲、安慰劑對(duì)照的臨床試驗(yàn)����。該試驗(yàn)招募了確診新冠陽(yáng)性,尚未住院�,但出現(xiàn)癥狀的成人患者。這些患者之前均未接受新冠疫苗注射����,也從未感染過(guò)新冠。FDA的新聞稿中提到�,臨床試驗(yàn)數(shù)據(jù)表明����,Paxlovid能顯著降低患者新冠相關(guān)住院或全因死亡的風(fēng)險(xiǎn)�。與安慰劑對(duì)照組相比,Paxlovid組中出現(xiàn)住院或死亡的患者比例減少了約88%(治療組0.8%�,安慰劑對(duì)照組6%)。此外����,安慰劑對(duì)照組中有9名患者死亡����,而治療組的數(shù)據(jù)為0名。目前�����,Paxlovid治療新冠的安全性和有效性還在接受進(jìn)一步的評(píng)估����。FDA的新聞稿中提到,適用這款藥物的人群有著限制����。他們需不小于12歲����,體重不低于40公斤����,且新冠病毒直接檢測(cè)的結(jié)果為陽(yáng)性。這些患者有較高風(fēng)險(xiǎn)發(fā)展為重癥新冠疾?����。ㄈ缱≡夯蛘咚劳觯?���。這是一款處方藥,可在新冠確診�����,且在癥狀出現(xiàn)的五天內(nèi)盡快使用�����。FDA同樣指出����,Paxlovid的授權(quán)并不包括新冠暴露前后的預(yù)防�����,也不包括危重癥新冠患者的治療���。Paxlovid并不能代替疫苗。同時(shí)���,緊急使用授權(quán)也不等同于FDA的完整批準(zhǔn)����。

藥明康德內(nèi)容團(tuán)隊(duì)制圖
“今日Paxlovid的批準(zhǔn)再次展示科學(xué)能如何幫助我們最終打敗疫情�����。盡管已經(jīng)發(fā)生了兩年�����,這場(chǎng)疫情依舊影響著全球人們的生活�����。這款具有突破性的療法能顯著減少住院和死亡風(fēng)險(xiǎn)�����,也能在家服用�,能改變我們治療新冠疾病的方式。我們希望它能減少一些醫(yī)療體系面臨的重大壓力��?����!陛x瑞首席執(zhí)行官Albert Bourla博士說(shuō)道�。回溯過(guò)往,這款創(chuàng)新療法的研發(fā)歷史還要從2002年說(shuō)起�。那時(shí),輝瑞的研發(fā)人員為了應(yīng)對(duì)SARS病毒(SARS-CoV-1)����,著手尋找3CL蛋白酶抑制劑,從而發(fā)現(xiàn)了nirmatrelvir的前體PF-00835231�����,在體外實(shí)驗(yàn)中����,它能夠強(qiáng)力抑制SARS-CoV-1的3CL蛋白酶活性�����。在新冠疫情爆發(fā)后��,科學(xué)家們馬上想到了這款在研化合物����,因?yàn)镾ARS病毒和新冠病毒的3CL蛋白酶在與底物結(jié)合的位點(diǎn)上具有100%的序列同源性�,這意味著nirmatrelvir很可能對(duì)新冠病毒的3CL蛋白酶具有強(qiáng)力的抑制效果。后續(xù)的實(shí)驗(yàn)也證明了這一點(diǎn)�����。

圖片來(lái)源:123RF
不過(guò)�����,最初發(fā)現(xiàn)的這款化合物不能口服使用��,面對(duì)新冠疫情的迅速擴(kuò)展��,研究人員馬不停蹄���,對(duì)它進(jìn)行了優(yōu)化�����,生成了PF-07321332�����,也就是后來(lái)的nirmatrelvir���。根據(jù)行業(yè)媒體《C&EN》的報(bào)道,2020年7月�����,科學(xué)家們首次合成了7毫克的化合物��。但要在人體中進(jìn)行臨床試驗(yàn)���,7毫克的化合物是遠(yuǎn)遠(yuǎn)不夠的����。輝瑞公司的210名科學(xué)家通力合作�����,到10月份,他們已經(jīng)合成了100克的化合物����,兩周之后,化學(xué)家們將合成能力提高到超過(guò)1000克����。科學(xué)家們的努力,讓nirmatrelvir的臨床試驗(yàn)得以迅速開(kāi)展��,也為今日的突破提供了強(qiáng)有力的支持����。新一代口服抗新冠病毒藥物的問(wèn)世,有望與新冠疫苗�、中和抗體和其它新冠療法一起,為人們提供多重保護(hù)��,有效遏制疫情的發(fā)展�。這是屬于科學(xué)的榮光!我們向快馬加鞭��,推動(dòng)新冠藥物開(kāi)發(fā)的研發(fā)人員致敬�����,也深深地感謝那些默默耕耘�����,為新冠疫苗和療法的成功奠基的科學(xué)家們����。是他們的共同努力,讓我們?cè)缛湛吹浇K結(jié)疫情的希望�����!
參考資料:
[1] Coronavirus (COVID-19) Update: FDA Authorizes First Oral Antiviral for Treatment of COVID-19, Retrieved December 22, 2021, from https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-oral-antiviral-treatment-covid-19
[2] Pfizer Receives U.S. FDA Emergency Use Authorization for Novel COVID-19 Oral Antiviral Treatment, Retrieved December 22, 2021, from https://www.businesswire.com/news/home/20211221005795/en





