2022年1月10日��,Idorsia公司宣布���,美國FDA已批準(zhǔn)Quviviq(daridorexant),用于治療失眠癥成人患者��。失眠癥是一種嚴(yán)重的睡眠障礙���,其特征是入睡和/或睡眠維持困難��。Quviviq是一款雙重食欲素受體(orexin receptor)拮抗劑��。與一般鎮(zhèn)靜大腦的療法不同��,它通過阻斷促覺醒神經(jīng)肽食欲素的結(jié)合��,抑制過度活躍的不眠狀態(tài)��。
本次批準(zhǔn)基于一項(xiàng)3期臨床項(xiàng)目獲得的積極結(jié)果��。該項(xiàng)目分為兩項(xiàng)關(guān)鍵性試驗(yàn)��,共入組1854例失眠癥成人患者��,患者隨機(jī)接受不同劑量的Quviviq或安慰劑每日1次給藥的治療��。兩項(xiàng)試驗(yàn)的主要療效終點(diǎn)為從基線到第1個(gè)月和第3個(gè)月���,患者進(jìn)入持續(xù)性睡眠所需時(shí)間(LPS)和入睡后覺醒(WASO)的變化。LPS是入睡的指標(biāo)��,WASO是睡眠維持的指標(biāo)���。試驗(yàn)次要終點(diǎn)是患者報(bào)告的總睡眠時(shí)間(sTST)���。
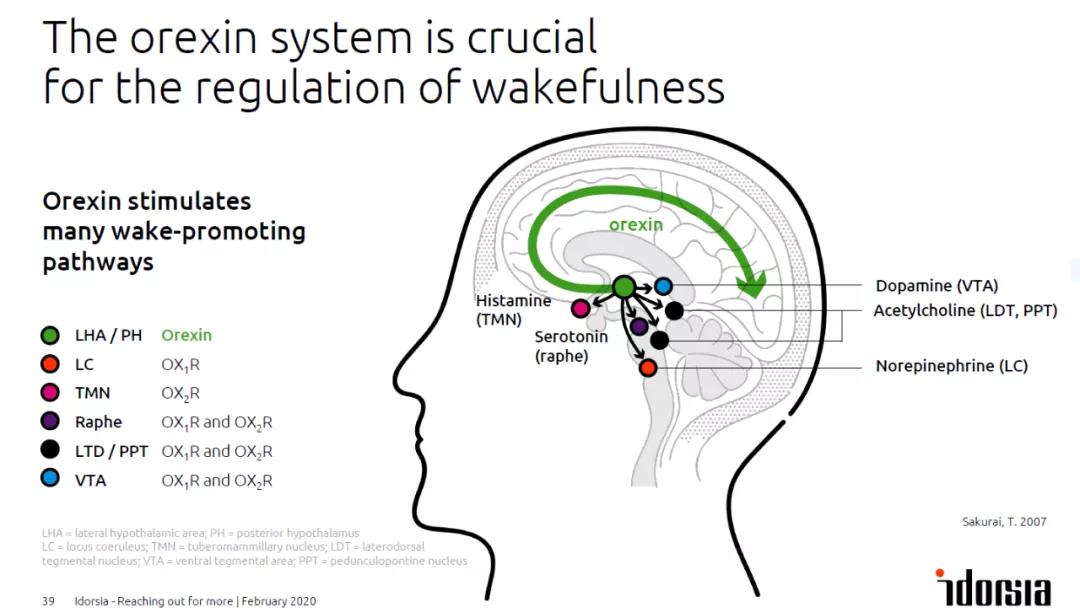
▲食欲素刺激多重促進(jìn)覺醒的信號(hào)通路(圖片來源:參考資料[2])
該3期臨床項(xiàng)目結(jié)果表明,與安慰劑組相比��,劑量為50 mg的Quviviq顯著改善患者入睡和睡眠維持的客觀指標(biāo)���、以及患者報(bào)告的總睡眠時(shí)間���。50 mg劑量水平的Quviviq還顯著減少了患者的日間嗜睡。安全性上��,最常見的不良反應(yīng)為頭痛���、嗜睡或疲乏��。Idorsia的首席科學(xué)官M(fèi)artine Clozel博士表示:“經(jīng)過20多年的研究���,和對(duì)食欲素在睡眠-覺醒平衡中的作用���、以及食欲素受體拮抗作用潛力的逐步理解,我們?cè)O(shè)計(jì)了daridorexant來幫助解決失眠患者面臨的多個(gè)問題���。Daridorexant的特性包括對(duì)兩種食欲素受體的強(qiáng)效抑制���,快速吸收,從而幫助入睡���,以及良好的藥代動(dòng)力學(xué)特征��。約80%的藥物在夜間睡眠后被消除��,可以幫助最大限度地減少殘留效應(yīng)���。”
參考資料:
[1] Idorsia receives US FDA approval of Quviviq (daridorexant) 25 and 50 mg for the treatment of adults with insomnia. Retrieved January 10, 2022, from https://www.idorsia.com/media/news-details?newsId=2665386
[2] Idorsia Company Presentation. Retrieved April 19, 2020, from https://www.idorsia.com/documents/com/fact-sheets-presentations/idorsia-company-presentation.pdf



