在癌細(xì)胞表面表達(dá)的PD-L1蛋白通過(guò)與免疫細(xì)胞表面表達(dá)的PD-1受體相結(jié)合�����,抑制抗癌免疫反應(yīng)的作用機(jī)制幫助開(kāi)發(fā)了革命性的創(chuàng)新免疫療法。然而這并不是PD-L1的唯一作用����,近年的研究發(fā)現(xiàn),PD-L1對(duì)表達(dá)它的癌細(xì)胞的生長(zhǎng)和生存�����、干細(xì)胞特性�、DNA損傷應(yīng)答和基因調(diào)控等多個(gè)方面都能產(chǎn)生影響。很多效果與PD-1無(wú)關(guān)���。這些發(fā)現(xiàn)表明���,PD-L1介導(dǎo)的細(xì)胞外信號(hào)通路雖然帶來(lái)有效抗癌療法,但并沒(méi)有完整反映了PD-L1作用的全貌����。近日���,Nature Reviews Cancer上發(fā)表的一篇綜述對(duì)PD-L1介導(dǎo)的癌細(xì)胞內(nèi)信號(hào)通路進(jìn)行了盤(pán)點(diǎn)�。今日���,藥明康德內(nèi)容團(tuán)隊(duì)將與讀者分享其中的部分精彩內(nèi)容��,點(diǎn)擊文末“閱讀全文/Read more”�,即可訪(fǎng)問(wèn)綜述網(wǎng)址。

PD-L1結(jié)構(gòu)和介導(dǎo)癌細(xì)胞內(nèi)信號(hào)傳導(dǎo)的方式
PD-L1蛋白包含5個(gè)主要蛋白域���。我們通常提到的PD-L1蛋白指的是人類(lèi)的全長(zhǎng)PD-L1蛋白����,它不但在表達(dá)在細(xì)胞表面的時(shí)候能夠介導(dǎo)癌細(xì)胞內(nèi)的信號(hào)傳導(dǎo)����,而且在細(xì)胞內(nèi)也可以調(diào)節(jié)一系列信號(hào)通路。PD-L1至少有6種亞型����,這些亞型因?yàn)榻Y(jié)構(gòu)不同,在信號(hào)傳導(dǎo)的能力上也有顯著的區(qū)別����。有些亞型可能具有重要的功能和預(yù)后影響,比如在復(fù)發(fā)型非小細(xì)胞肺癌患者中發(fā)現(xiàn)一種分泌的PD-L1亞型可以通過(guò)與抗PD-L1抗體結(jié)合����,介導(dǎo)對(duì)免疫檢查點(diǎn)抑制劑的耐藥性����。
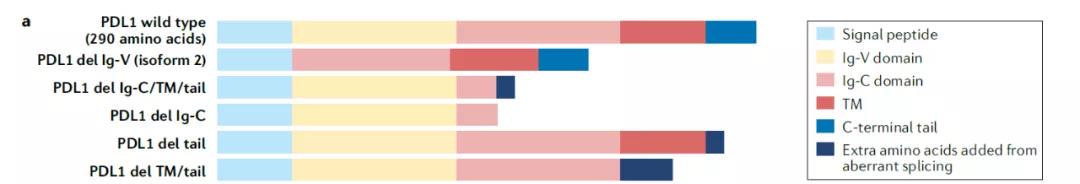
▲PD-L1的蛋白結(jié)構(gòu)域和亞型(圖片來(lái)源:參考資料[1])
細(xì)胞表面的PD-L1介導(dǎo)的信號(hào)位于細(xì)胞表面的全長(zhǎng)PD-L1通過(guò)與PD-1結(jié)合���,能夠通過(guò)細(xì)胞內(nèi)的C端蛋白域介導(dǎo)不同的信號(hào)通路�����。比如�����,黑色素瘤中�,癌細(xì)胞表面表達(dá)的PD-1通過(guò)與PD-L1結(jié)合��,能夠激活mTORC1����,并導(dǎo)致細(xì)胞增殖和動(dòng)物模型中腫瘤的生長(zhǎng)。與之相反�����,在非小細(xì)胞肺癌細(xì)胞和動(dòng)物模型中�,PD-1和PD-L1結(jié)合引發(fā)的PD-L1介導(dǎo)信號(hào)會(huì)抑制MAPK-ERK信號(hào)傳導(dǎo),抑制腫瘤生長(zhǎng)����。科學(xué)家們?nèi)匀恍枰嗟难芯縼?lái)解釋不同癌癥種類(lèi)中PD-L1介導(dǎo)信號(hào)的不同作用���。這可能與特定遺傳背景����、腫瘤生物學(xué)����、或細(xì)胞特異性轉(zhuǎn)譯后PD-L1或PD-1的修飾相關(guān)。細(xì)胞內(nèi)存在的PD-L1介導(dǎo)的信號(hào)細(xì)胞內(nèi)的全長(zhǎng)PD-L1蛋白雖然與表達(dá)在細(xì)胞表面的PD-L1蛋白序列相同����,但是它的N端結(jié)構(gòu)域很可能沒(méi)有完成折疊,因此讓細(xì)胞內(nèi)PD-L1與不同的蛋白和其它生物分子相結(jié)合����。值得關(guān)注的是,細(xì)胞質(zhì)中的PD-L1能夠與mRNA結(jié)合并穩(wěn)定mRNA�����,導(dǎo)致特定DNA損傷修復(fù)蛋白表達(dá)水平的上升。在特定三陰性乳腺癌細(xì)胞系中��,細(xì)胞核周或核內(nèi)的PD-L1可以與DNA依賴(lài)性蛋白激酶結(jié)合�,激活MAPK或ERKs,促進(jìn)細(xì)胞生存信號(hào)傳導(dǎo)����。這兩種作用機(jī)制能夠在不依賴(lài)PD-1或CD80這兩種可以與PD-L1結(jié)合的蛋白的情況下,促進(jìn)對(duì)某些細(xì)胞毒性化療的耐藥性����。細(xì)胞核內(nèi)的PD-L1還可以直接與DNA相結(jié)合,綜述作者預(yù)測(cè)����,細(xì)胞核內(nèi)的PD-L1可能參與DNA損傷修復(fù)通路,從而調(diào)控DNA損傷修復(fù)和對(duì)化療的耐藥性����,不過(guò)潛在作用機(jī)制仍然需要實(shí)驗(yàn)澄清。
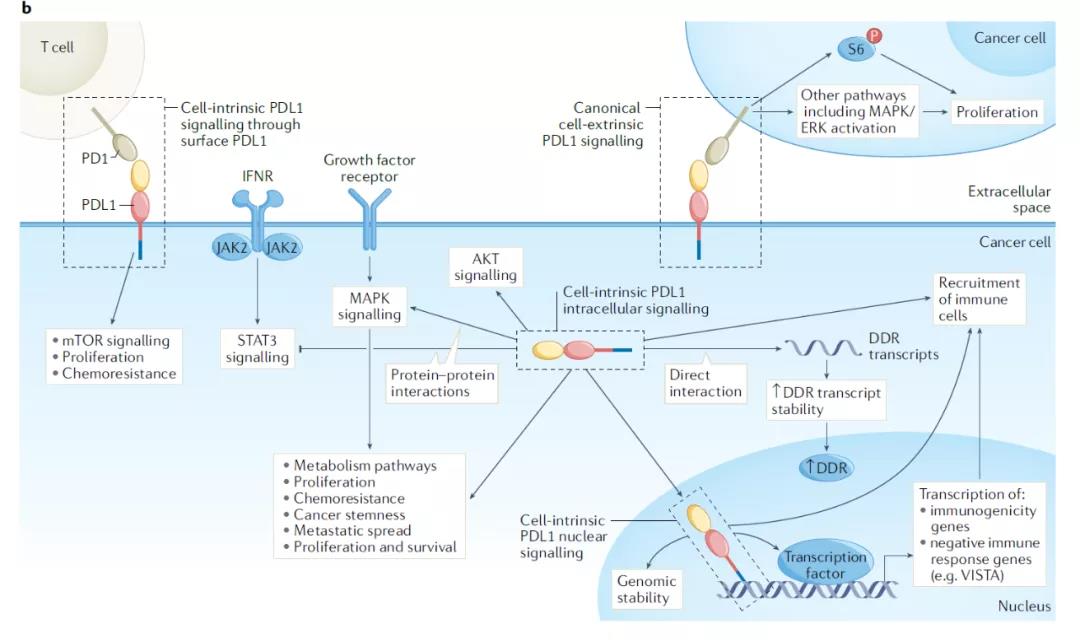
▲PD-L1影響多種癌細(xì)胞內(nèi)的信號(hào)通路(圖片來(lái)源:參考資料[1])
癌細(xì)胞內(nèi)PD-L1介導(dǎo)信號(hào)的免疫學(xué)后果PD-L1通過(guò)與PD-1結(jié)合對(duì)免疫細(xì)胞的影響是抗癌免疫療法的基石���,這一作用機(jī)制已經(jīng)廣為人知���。與之相比,癌細(xì)胞內(nèi)PD-L1介導(dǎo)的信號(hào)通路對(duì)抗癌免疫反應(yīng)的影響卻很少受到關(guān)注�。PD-L1可以通過(guò)抑制STAT3的激活,在小鼠黑色素瘤細(xì)胞中抑制對(duì)IFNα和IFNβ和IFNγ的敏感性���,也可以在小鼠三陰性乳腺癌體外和體內(nèi)模型中促進(jìn)細(xì)胞焦亡���,從而增強(qiáng)腫瘤的免疫原性細(xì)胞死亡。有趣的是���,細(xì)胞核內(nèi)的PD-L1可以在不同三陰性乳腺癌細(xì)胞系中促進(jìn)I型主要組織相容復(fù)合體(MHC)的表達(dá)�����,理論上這可以改善抗原特異性免疫識(shí)別或抑制自然殺傷細(xì)胞�。通過(guò)在人類(lèi)乳腺癌和結(jié)腸癌細(xì)胞中調(diào)節(jié)DNA損傷反應(yīng)�����,和/或?qū)?xì)胞質(zhì)中損傷核苷酸的感知�,PD-L1可以影響腫瘤的免疫原性。值得注意的是���,有些PD-L1介導(dǎo)的癌細(xì)胞內(nèi)信號(hào)通路����,特別是細(xì)胞內(nèi)PD-L1介導(dǎo)的信號(hào),明顯不會(huì)受到抗PD-L1抗體的影響����。這意味著,設(shè)計(jì)新的方法來(lái)靶向癌細(xì)胞內(nèi)的PD-L1信號(hào)可能輔助抗PD-L1抗體的作用��。
綜述指出���,癌細(xì)胞內(nèi)PD-L1介導(dǎo)的信號(hào)可以在三個(gè)領(lǐng)域被應(yīng)用于臨床開(kāi)發(fā):作為單藥療法或組合療法的靶點(diǎn)����,作為治療應(yīng)答的生物標(biāo)志物�����,或作為預(yù)后生物標(biāo)志物���。全面降低細(xì)胞PD-L1蛋白表達(dá)的策略多個(gè)團(tuán)隊(duì)已經(jīng)用實(shí)驗(yàn)證明了清除腫瘤PD-L1的小分子作為抗癌療法的潛力����。比如,名為verteporfin的小分子化合物能夠降低特定人類(lèi)腫瘤細(xì)胞系�、免疫和基質(zhì)細(xì)胞中的PD-L1,它可以在小鼠卵巢癌模型中改善PARP抑制劑的療效��。天然產(chǎn)物姜黃素能夠促進(jìn)PD-L1的泛素化�����,從而清除癌細(xì)胞中的PD-L1����。它在小鼠三陰性乳腺癌模型中改善抗CTLA-4免疫療法的療效���。一些小分子抑制劑也具有降低細(xì)胞PD-L1表達(dá)的效果����,比如�,EGFR抑制劑gefitinib能夠降低PD-L1的表達(dá)水平,在動(dòng)物模型中改善抗PD-1免疫療法的功效���。EGFR抑制劑erlotininb和osemertinib在人類(lèi)小細(xì)胞肺癌細(xì)胞系中也有抑制腫瘤PD-L1表達(dá)的效果����。綜述的作者通過(guò)挖掘藥物化合物庫(kù)發(fā)現(xiàn)了17款清除腫瘤PD-L1的候選療法,它們平均能將PD-L1水平降低超過(guò)2.6倍��。這些化合物具有改善DNA損傷反應(yīng)抑制劑療效的功能��。小分子之外�,抗體、多肽和反義寡核苷酸都可以用于降低PD-L1的表達(dá)���。值得一提的是�,雖然PD-L1缺失的腫瘤可能對(duì)IFNα�����、IFNβ���、IFNγ或損傷DNA的細(xì)胞毒性藥物更為敏感���,也有不少研究報(bào)告癌細(xì)胞內(nèi)的PD-L1信號(hào)介導(dǎo)對(duì)化療的耐藥性,但是一個(gè)重要的例外是在攜帶BRAF V600E突變的結(jié)腸癌細(xì)胞中�����,PD-L1的表達(dá)反而提高了對(duì)化療的敏感性���。這意味著清除細(xì)胞內(nèi)PD-L1可能對(duì)某些療法有益����,但是增加對(duì)另一些療法的耐藥性。
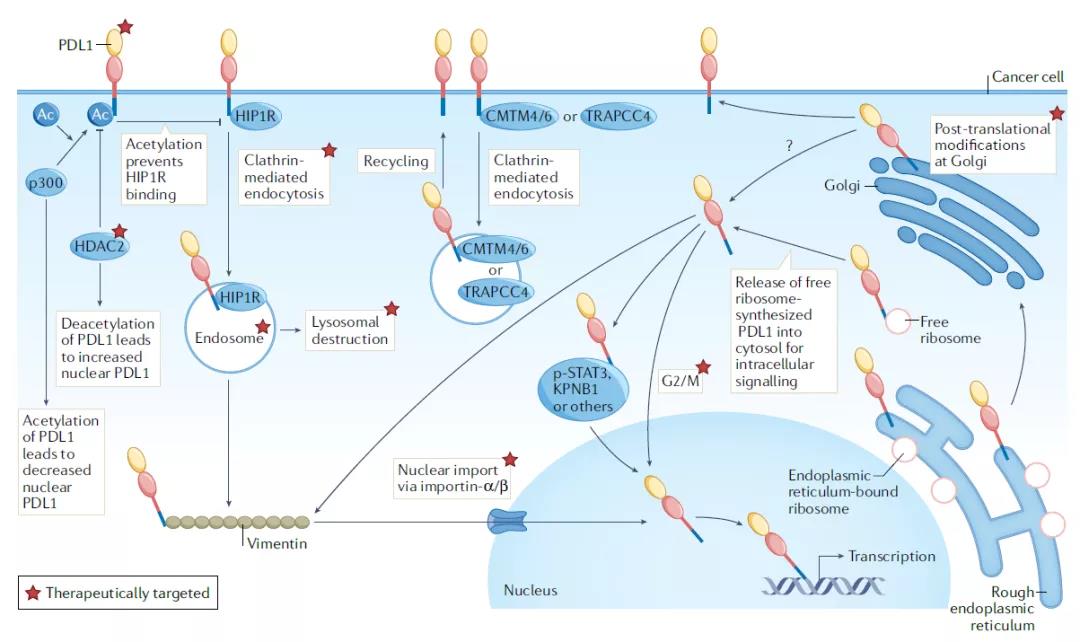
▲調(diào)控細(xì)胞內(nèi)PD-L1的機(jī)制和潛在藥物靶點(diǎn)(圖片來(lái)源:參考資料[1])
在細(xì)胞內(nèi)不同亞細(xì)胞區(qū)域PD-L1的功能有所不同����,因此,清除特定亞細(xì)胞區(qū)域的PD-L1可能比全面清除PD-L1獲得更好的效果�。比如����,肺癌轉(zhuǎn)移瘤中細(xì)胞核內(nèi)的PD-L1水平比原位瘤更高,如果核內(nèi)PD-L1導(dǎo)致肺癌轉(zhuǎn)移瘤的免疫檢查點(diǎn)抑制劑耐藥性的話(huà)����,清除核內(nèi)PD-L1的藥物可能提高免疫檢查點(diǎn)抑制劑的療效。在結(jié)腸癌細(xì)胞系中����,一款靶向HDAC2的小分子抑制劑能夠降低腫瘤細(xì)胞核內(nèi)PD-L1的積累,實(shí)驗(yàn)表明它能夠改善抗PD-1免疫療法的效果��。
綜述作者指出����,PD-L1產(chǎn)生的癌細(xì)胞內(nèi)信號(hào)可以影響生長(zhǎng)���、生存、轉(zhuǎn)移��、代謝���、分化���、干細(xì)胞特征和療法耐藥通路。這些通路雖然錯(cuò)綜復(fù)雜���,但是也提供了潛在可操作的創(chuàng)新靶點(diǎn)�����。它們可能帶來(lái)更為有效的療法�����,或者改善已有療法的療效�。目前�����,為晚期癌癥患者開(kāi)發(fā)創(chuàng)新免疫療法和理性設(shè)計(jì)組合療法來(lái)改善患者預(yù)后受到人們的廣泛關(guān)注,作者預(yù)計(jì)靶向癌細(xì)胞內(nèi)PD-L1信號(hào)將在這一領(lǐng)域大有作為�����。
參考資料:
[1] Kornepati et al., (2022). Programmed death ligand 1 signals in cancer cells. Nature Reviews Cancer, https://doi.org/10.1038/s41568-021-00431-4
文章來(lái)源:藥明康德





