今日,賽諾菲(Sanofi)公司宣布,美國(guó)FDA授予該公司與Sobi合作開發(fā)的efanesoctocog alfa(BIVV001)突破性療法認(rèn)定�,用于治療血友病A患者。新聞稿指出��,這是首個(gè)獲得突破性療法認(rèn)定的凝血因子VIII(FVIII)療法�。Efanesoctocog alfa是一款長(zhǎng)效血友病A療法,目標(biāo)是通過每周一次預(yù)防性治療�,在一周的大部分時(shí)間中維持接近正常的FVIII活性。血友病A是由于編碼FVIII的基因出現(xiàn)突變��,導(dǎo)致FVIII缺失的遺傳性疾病�。目前常見的血友病A治療方法是定期輸注FVIII,然而通?���;颊咝枰恐芙邮?-4次FVIII輸注,為他們的生活帶來極大的不便����。天然FVIII在血液中的半衰期只有12個(gè)小時(shí)左右,因?yàn)樵谘褐?,它與血管性血友病因子(von Willebrand factor ,VWF)結(jié)合形成復(fù)合體�。VWF與FVIII的結(jié)合雖然提高了FVIII在血液中的穩(wěn)定性,但是VWF本身被降解的速度也為FVIII在血液中的滯留時(shí)間設(shè)置了一個(gè)上限��,因?yàn)楫?dāng)VWF被降解時(shí)�,與它結(jié)合的FVIII也同時(shí)被降解。BIVV001的設(shè)計(jì)將FVIII與一個(gè)VWF片段連接起來����,形成的復(fù)合體不會(huì)與血液中的天然VWF相結(jié)合��,從而突破VWF設(shè)定的半衰期上限�。它旨在讓血友病A患者在接受一次注射之后�,能夠在一周的大部分時(shí)間里獲得接近正常的FVIII因子活性水平。
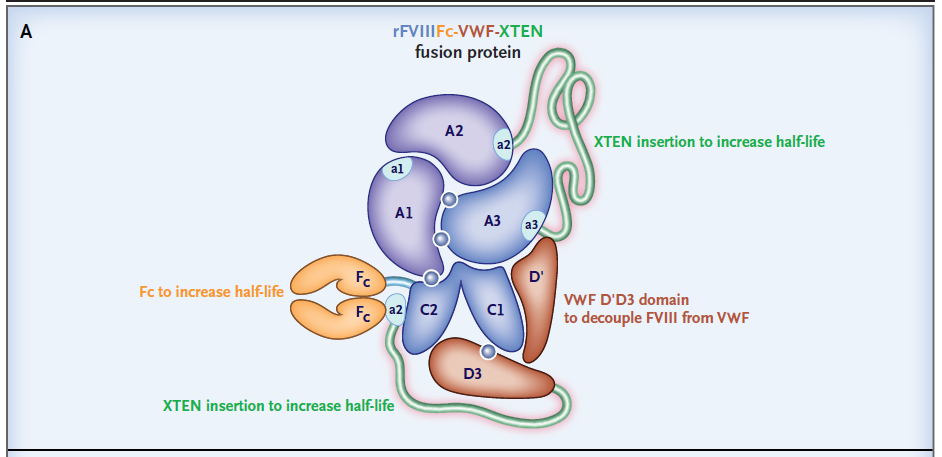
▲BIVV001結(jié)構(gòu)示意圖(圖片來源:參考資料[2])
這一突破性療法認(rèn)定的授予是基于關(guān)鍵性3期臨床試驗(yàn)XTEND-1的積極結(jié)果�。試驗(yàn)結(jié)果顯示,每周一次efanesoctocog alfa預(yù)防性治療�,顯著降低嚴(yán)重血友病A患者中的年出血率。同時(shí)��,與此前接受的FVIII預(yù)防性治療相比���,efanesoctocog alfa在預(yù)防出血方面表現(xiàn)出優(yōu)效性����。賽諾菲研發(fā)全球負(fù)責(zé)人John Reed博士表示:“突破性療法認(rèn)定凸顯了efanesoctocog alfa變革血友病A治療的潛力����,它能夠在更長(zhǎng)時(shí)間里提供更高的保護(hù)���。我們期待與監(jiān)管機(jī)構(gòu)在申請(qǐng)遞交和審評(píng)這一創(chuàng)新療法的過程中繼續(xù)合作��?�!?/span>
參考資料:
[1] Press Release: FDA grants efanesoctocog alfa Breakthrough Therapy designation for hemophilia A. Retrieved June 1, 2022, from https://www.globenewswire.com/news-release/2022/06/01/2453803/0/en/Press-Release-FDA-grants-efanesoctocog-alfa-Breakthrough-Therapy-designation-for-hemophilia-A.html
[2] Konkle et al., (2020). BIVV001 Fusion Protein as Factor VIII Replacement Therapy for Hemophilia A. NEJM, DOI: 10.1056/NEJMoa2002699
文章來源:藥明康德



